Preparación del inóculo
Se utilizan cultivos axénicos de Aspergillus flavus, A. parasiticus, A. nomius, entre otros, aislados de diferentes sustratos para determinar si son cepas productoras de aflatoxinas. El inóculo se prepara en tubos de cultivo (1.5 por 15 cm) con medio de papa-dextrosa-agar (PDA) y una asada de esporas de la cepa del moho a evaluar.
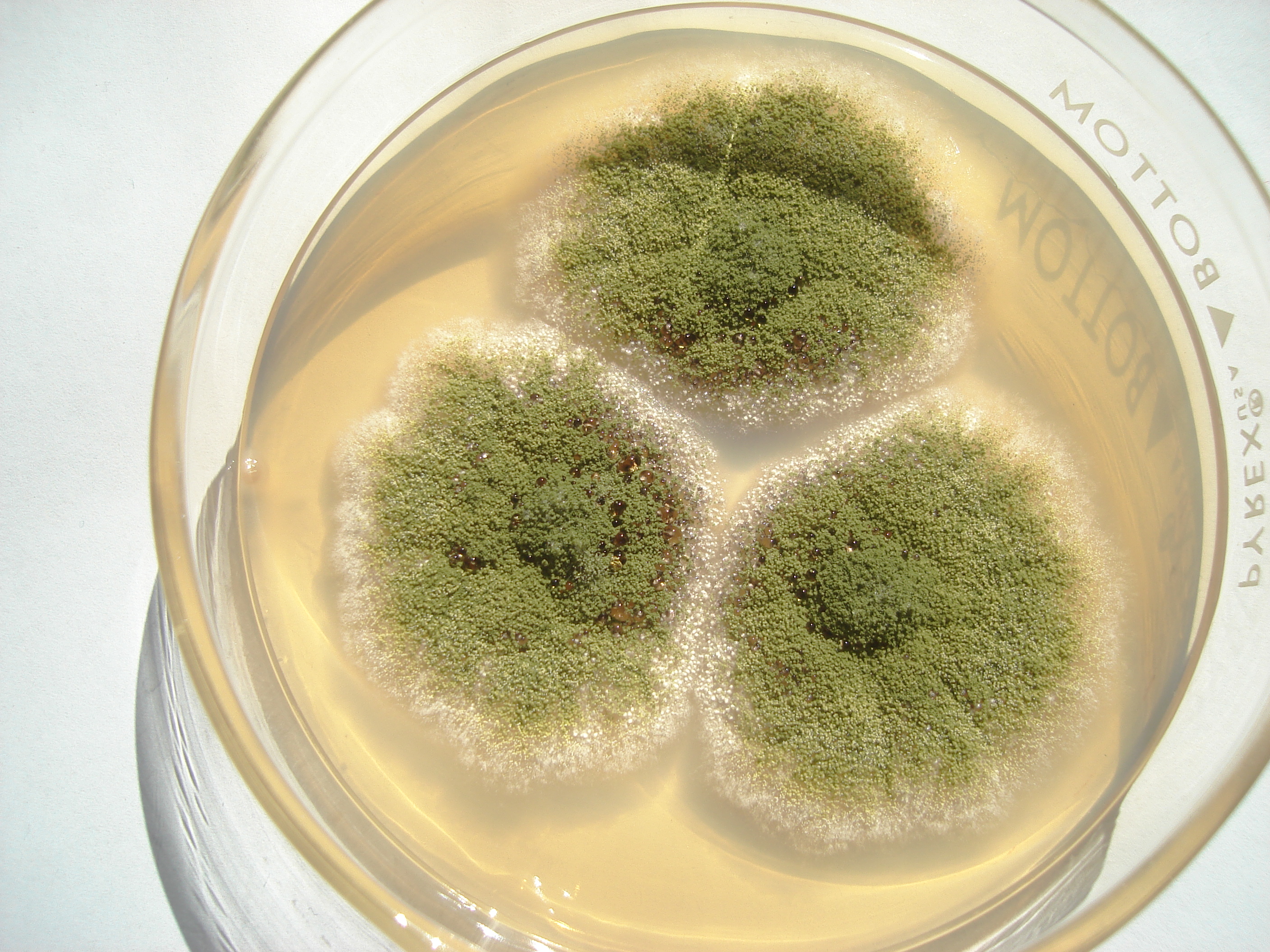
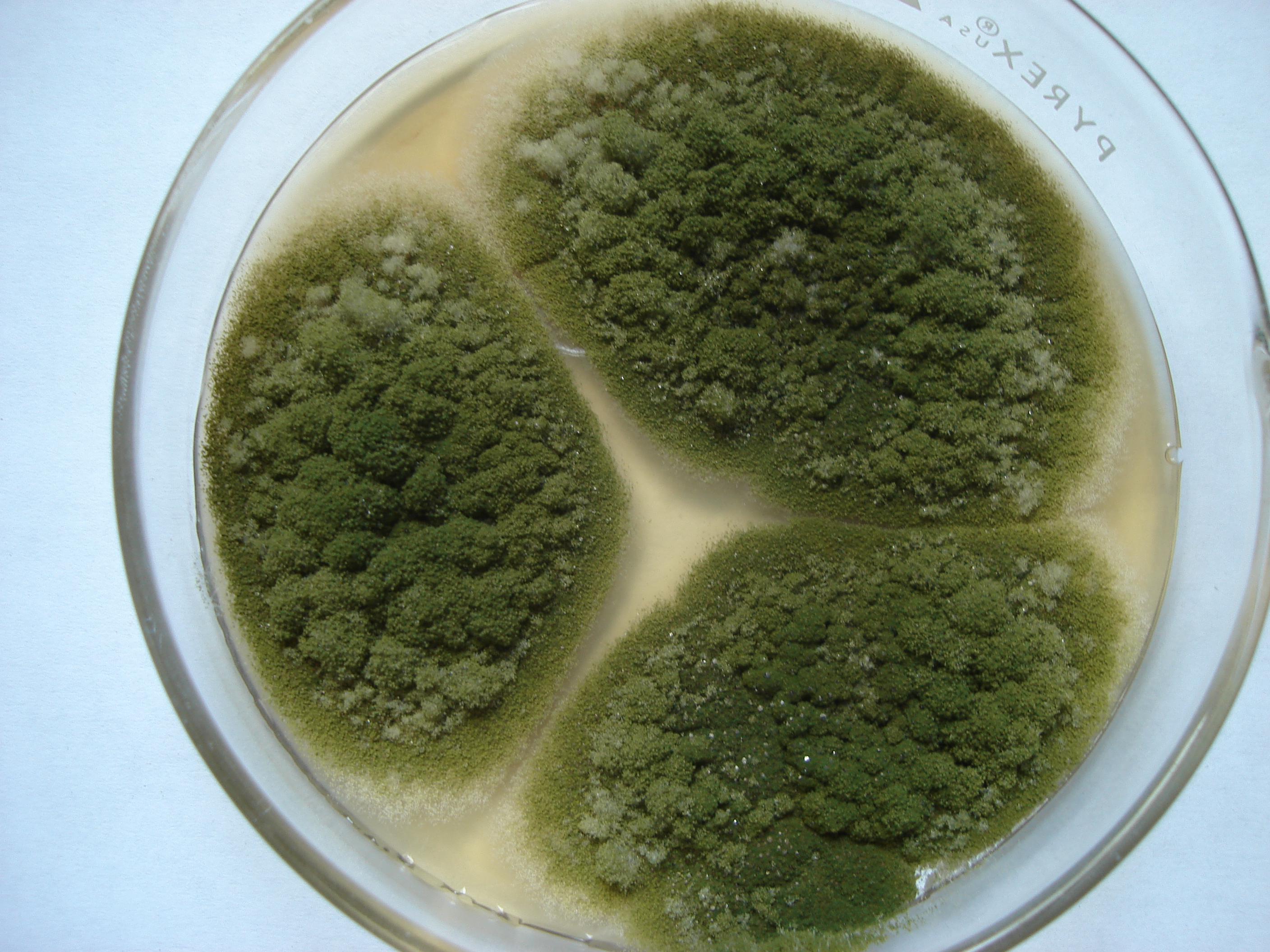
Figura 1. a) Colonias de Aspergillus flavus y b) A. parasiticus
Preparación del medio de cultivo
Matraz 1 adicionar 100 ml agua destilada, 20 g dextrosa, 0.2 g CaCO3 y 0.2 g MgSO4 .7H2O.
Matraz 2 agregar 400 ml de agua destilada y 15 g de agar.
Matraz 3 añadir 200 g de papas (peladas y cortadas en rodajas) y 500 ml de agua destilada. El contenido del matraz 3 se esteriliza durante 5 min., a 121° C y 15 libras de presión en una autoclave y se filtra a través de cuatro capas de manta de cielo. La solución se lleva al volumen original. Simultáneamente, el agar en el matraz 2 se calienta en baño María y la solución en el matraz 1 se calienta a ebullición. El contenido de los tres matraces se homogeniza hasta obtener una mezcla uniforme, el medio de cultivo se vacía en los tubos (7 ml) y se esteriliza en autoclave, después los tubos se inclinan hasta que solidifique el medio de cultivo.

Figura 2. a) Preparación de tubos con medio de cultivo y 2 b) tubos inclinados con PDA.
Los tubos de cultivo con medio inclinado se inoculan con cepas de A. flavus y se incuban por 7 días a 28° C, de cada cepa se hacen tres repeticiones. Después de este periodo de incubación los cultivos presentan una gran cantidad de conidios verdes, agregar 3 ml de 0.005% Tritón X-100 por tubo. Raspar los cultivos para desprender las esporas con un asa bacteriológica. Posteriormente el tubo se agita manualmente para obtener una suspensión uniforme de fragmentos miceliares y conidios.

Figura 3. Cultivos de A. flavus en tubo

Figura 4. Cultivos de A. flavus con 3 ml de Tritón X-100.
Proceso de fermentación
La fermentación se lleva a cabo en matraces Erlenmeyer de 250 ml (1 matraz para cada tubo de cultivo) que contienen 50 g de arroz pulido (de grano largo), agregar 25 ml de agua, dejar reposar durante dos horas y después lavar varias veces, hasta eliminar la mayor cantidad de almidón. Los matraces conteniendo el arroz lavado se esterilizan en la autoclave a 15 libras de presión durante 15 min y se dejan enfriar.

Figura 5. Matraces con arroz esterilizado y listos para ser inoculados con A. flavus.
El arroz se inocula con 0.5 ml de la suspensión de esporas y se incuba en un agitador a 28° C y 188 rev/min, en agitación continua. Adicionar, si es necesario, hasta 5 ml de agua estéril a las 24 y 45 h, lo suficiente para evitar que los granos de arroz se adhieran entre sí. Si el arroz se apelmaza y forma grumos, los matraces se retiran del agitador y el material se afloja agitando de forma manual cada matraz vigorosamente. Es importante que el arroz no forme una masa compacta, para favorecer la colonización y crecimiento del hongo en los granos.


Figura 6 y 7. Matraces con arroz inoculados con A. flavus en agitación
Después de 48 h de la inoculación, los granos de arroz deben mostrar pequeñas áreas blancas que corresponden al desarrollo del micelio de estos mohos. Posteriormente, el arroz cambia a un color amarillo brillante, debido a la formación de conidios, que se oscurece a un color marrón como el color del trigo.


Figura 8 y 9. El moho empieza a crecer en el arroz y después de 6 días.
Al final de fermentación (5 a 6 días), los matraces se esterilizan en autoclave para destruir el hongo, se deja enfriar a temperatura ambiente y el arroz inoculado con las cepas de A. flavus se secan en un horno a 50° C, el arroz se muele y se guarda en bolsas de papel encerado en el congelador hasta su análisis químico.

Figura 10. El Esterilizar los matraces por 5 min.

Figura 11. Se muelen y se guardan en bolsas en congelación.