Es un hongo que tiene una distribución cosmopolita, se han determinado más de 250 especies, habitante del suelo, saprótrofo, endófito, causante de alergias y micosis en el humano, muchas de sus especies son patógenas de plantas de cultivos económicamente importantes, como el trigo, tabaco, maíz, cacahuate, sorgo, cebada, alfalfa, pastos, entre otros, incluso algunas de estas especies pueden ser transmitidas a través de las semillas de un ciclo agrícola a otro. Dichas especies también causan problemas durante el transporte y almacenamiento de los productos vegetales, como granos y semillas, e incluso enmohecimientos severos de frutos (manzana, pera, melón, uvas, uvas pasa, fresas, aceitunas, higos deshidratados, albaricoque, cítricos), hortalizas (tomate, pimiento, zanahoria) y en vegetales en refrigeración, por desarrollarse adecuadamente a temperaturas bajas. El género Alternaria además de causar diversas enfermedades en los cultivos, se caracteriza por producir micotoxinas las cuales producen efectos adversos para la salud humana y animal e incluso también pueden mostrar efectos fitotóxicos, por lo cual se debe poner mayor atención en su estudio y determinación. Algunos de estos compuestos se han asociado con efectos mutágenos, carcinógenos, genotóxicos y citotóxicos, sin embargo, aún no existe una regulación a nivel internacional de ninguna de las micotoxinas sintetizadas por las especies del género Alternaria.

Figura 1. Alternaria spp. en cereales como el sorgo, durante la cosecha, transporte y almacenamiento.
Taxonomía
El género Alternaria fue descrito originalmente por Nees (1816), considerando como única especie a Alternaria tenuis, describiendo la septación de los conidios, la forma de la célula apical y el color. Posteriormente otros autores revisaron y volvieron a describir el género Alternaria basados también en las características morfológicas de los conidios, tamaño, patrones de esporulación, longitud de las cadenas de conidios, forma de la célula apical llamada pico (Saccardo 1886; Elliot 1917; Ellis, 1971; Ellis, 1976; Simmons 1997). En el 2007 Simmons en su manual para la identificación del género Alternaria describió 276 especies, distinguiendo dos secciones que se separaron por la morfología de los conidios, patrones de esporulación, hospedantes, sustrato y el tamaño de los conidios. En la Sección I incluyó todas aquellas especies con conidios de tamaño mediano o grande (60-100 µm), diferenciándolas por el tipo de célula apical del conidio denominada pico, mientras que en la Sección II incluyó especies con conidios pequeños (˂ 60 µm) y el patrón de esporulación que presentan, el cual puede ser simple o formando cadenas ramificadas de más de 2 ó 3 conidios. Posteriormente el género se separó en 24 secciones basados en estudios morfológicos y filogenias moleculares, en donde, 16 fueron nuevamente descritas y seis consideradas linajes monotipo. Como resultado de esta nueva clasificación algunas especies descritas con conidios pequeños por Simmons como Alternaria gaisen, A. tenuissima, A. arborescens, A. longipes entre otras fueron incluidas en la Sección Alternata integrando un complejo de 60 especies, considerando a la especie tipo a A. alternata. Asimismo, A. infectoria considerada también dentro del grupo de conidios pequeños, quedó incluida como especie tipo dentro de la sección Infectoriae (Woudenberg, 2013, 2014; Grum-Grzhimaylo et al., 2015). En el año 2020 Nishikawa y Nakashima describieron 85 aislados del género Alternaria los cuales, basados en descripciones morfológicas, patogenicidad y características filogenéticas moleculares, correspondieron a 23 especies incluidas en 14 secciones ya conocidas. Asimismo, identificaron tres nuevas especies A. cilindrica, A. gomprenae y A. triangularis.
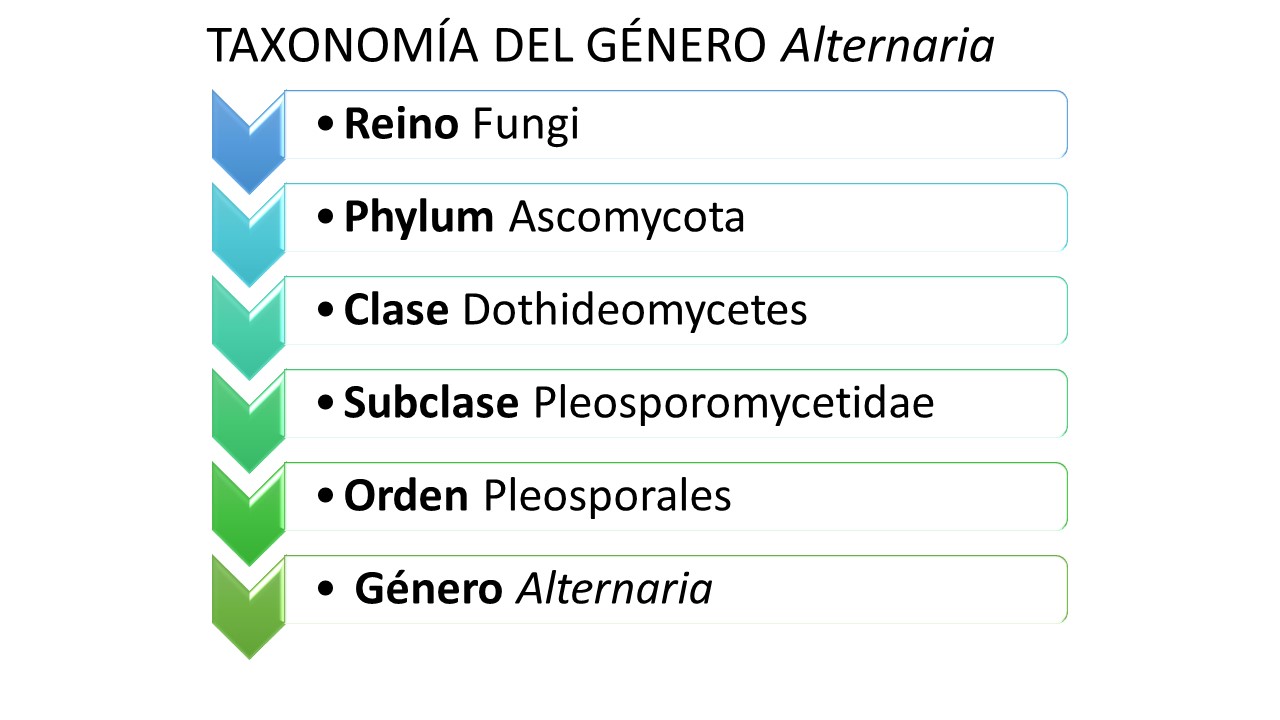
Figura 2. Clasificación del género Alternaria.
(Fuente: http://www.indexfungorum.org/names/Names.asp?strGenus=Alternaria)
Morfología
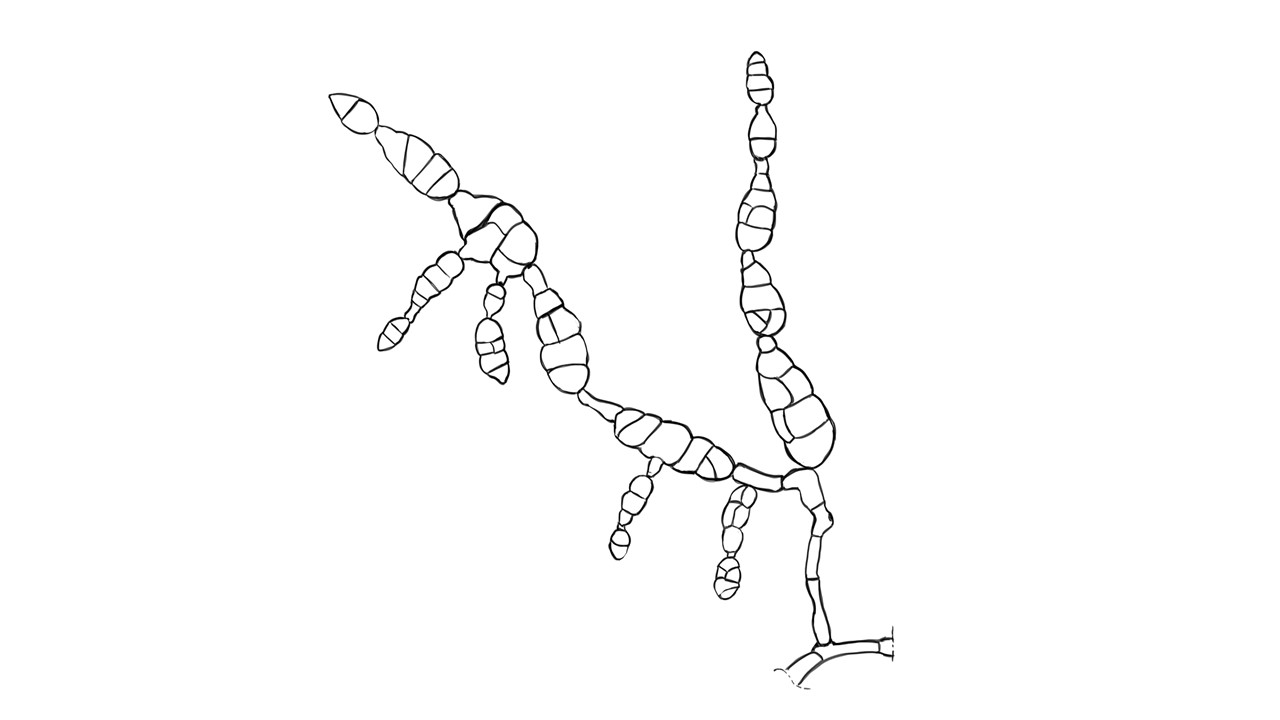
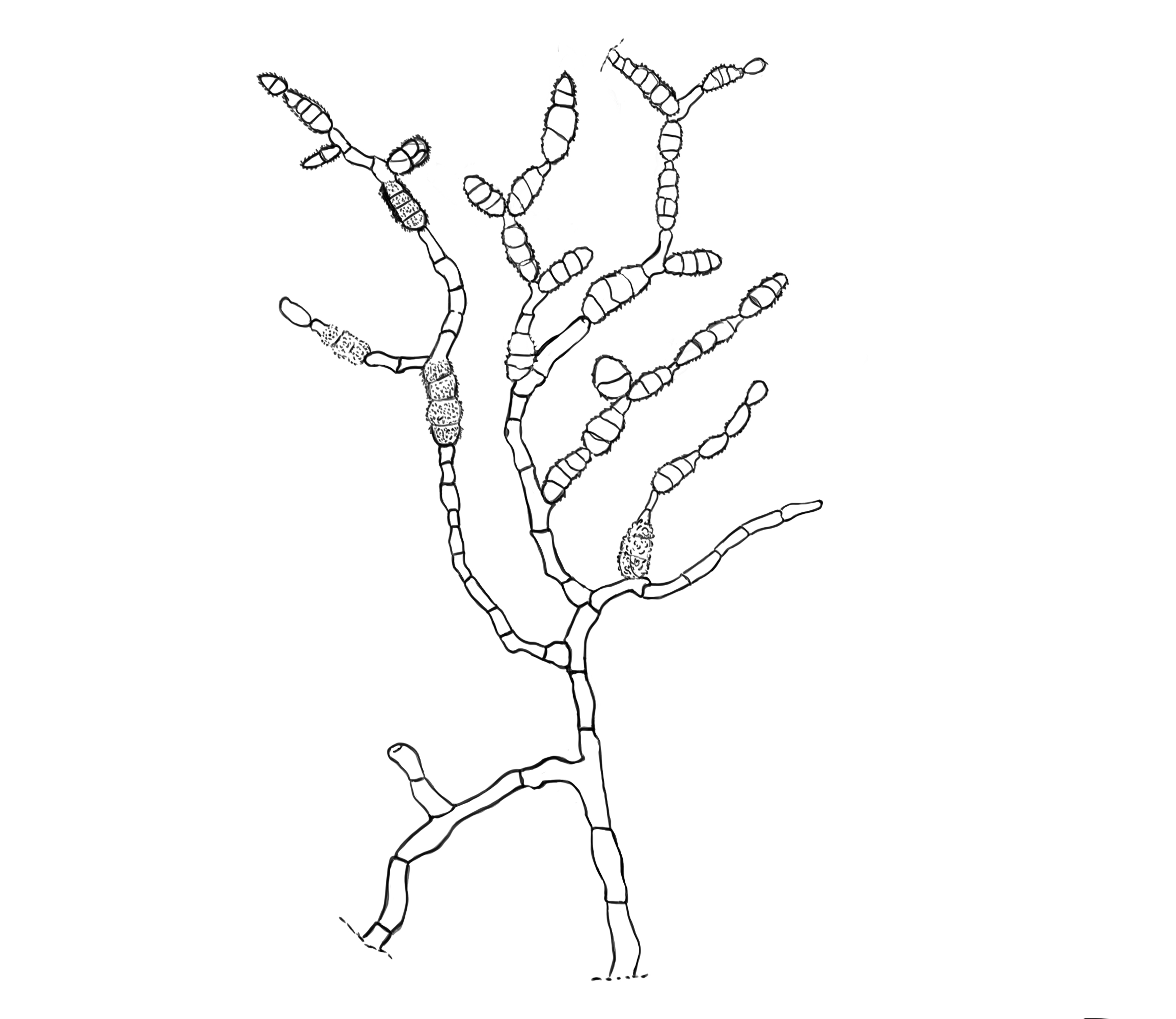
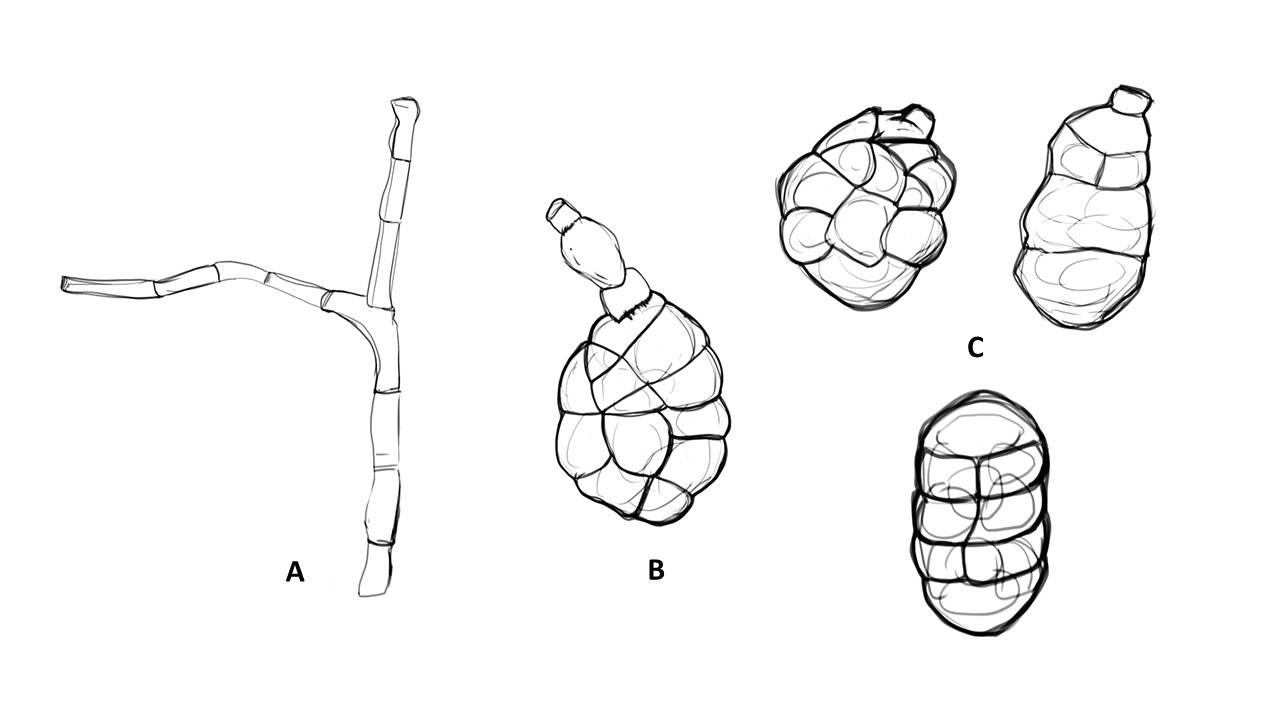
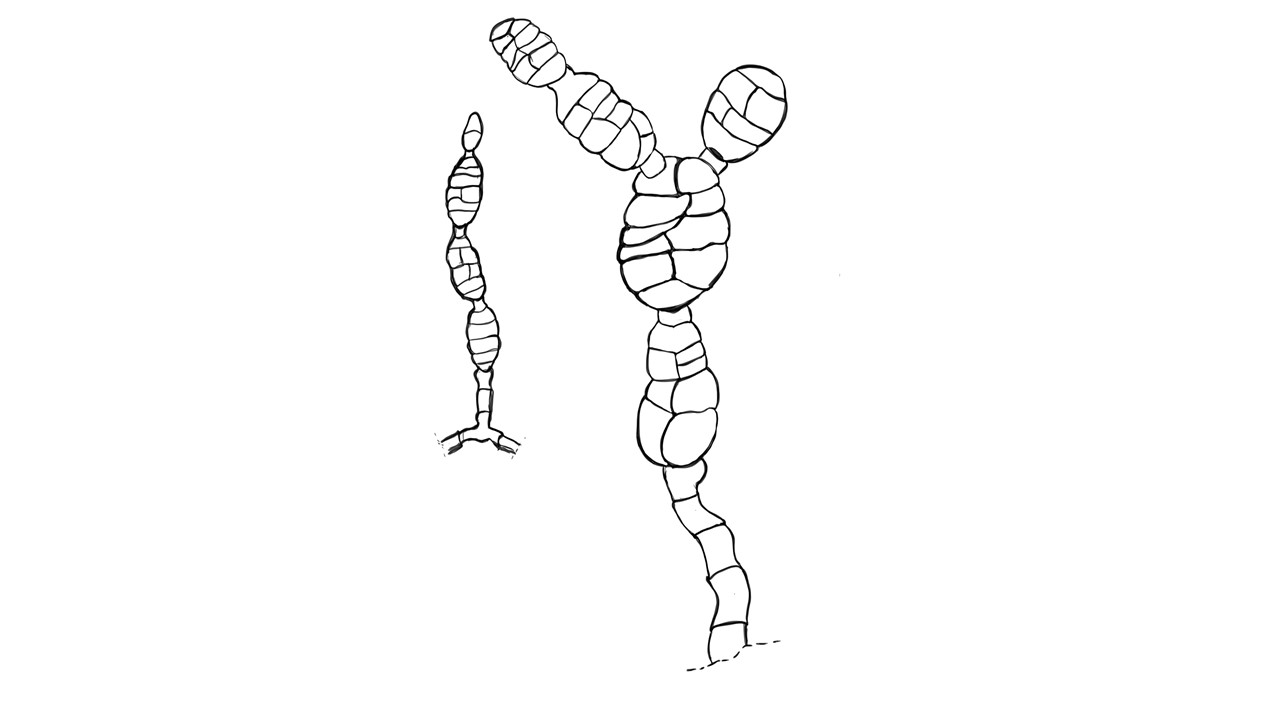
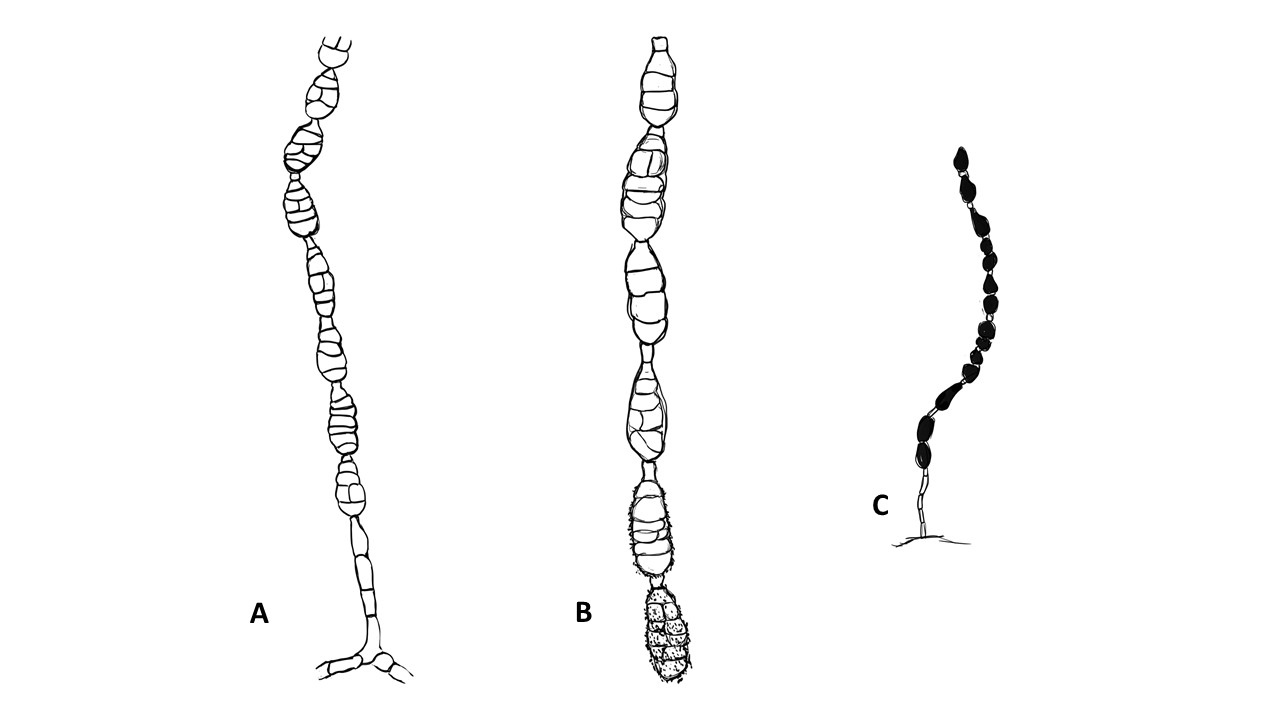
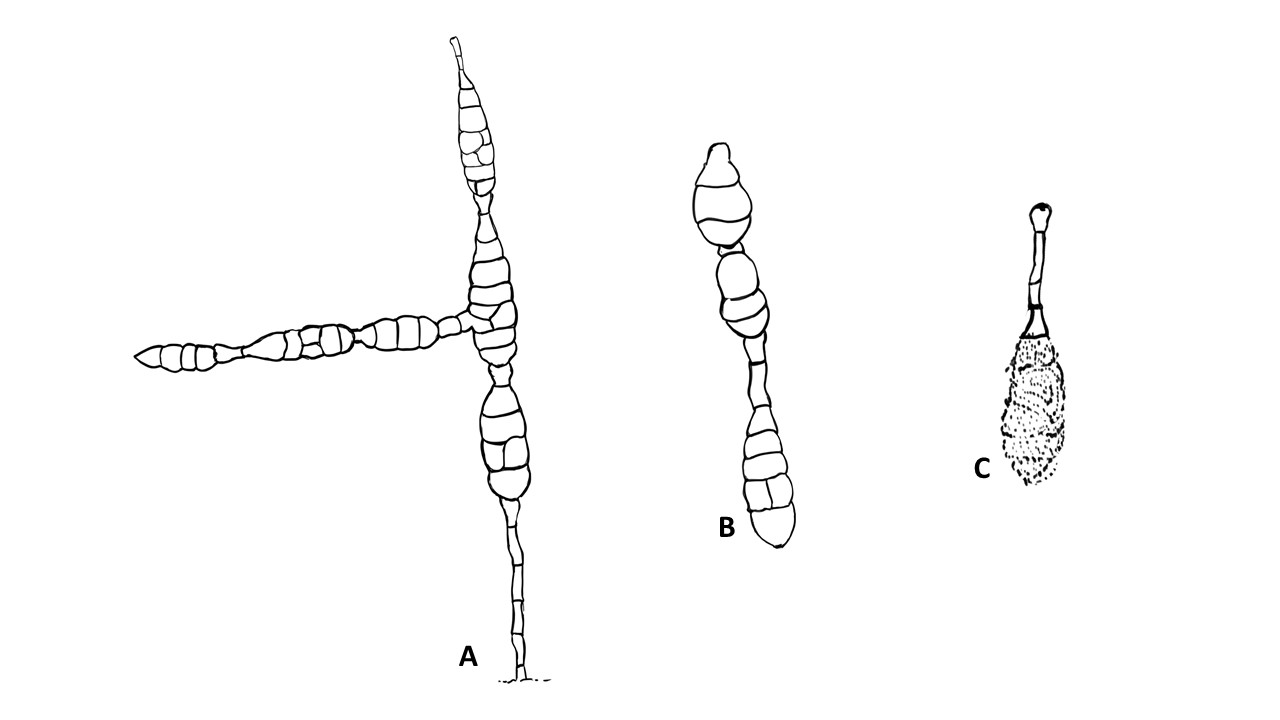
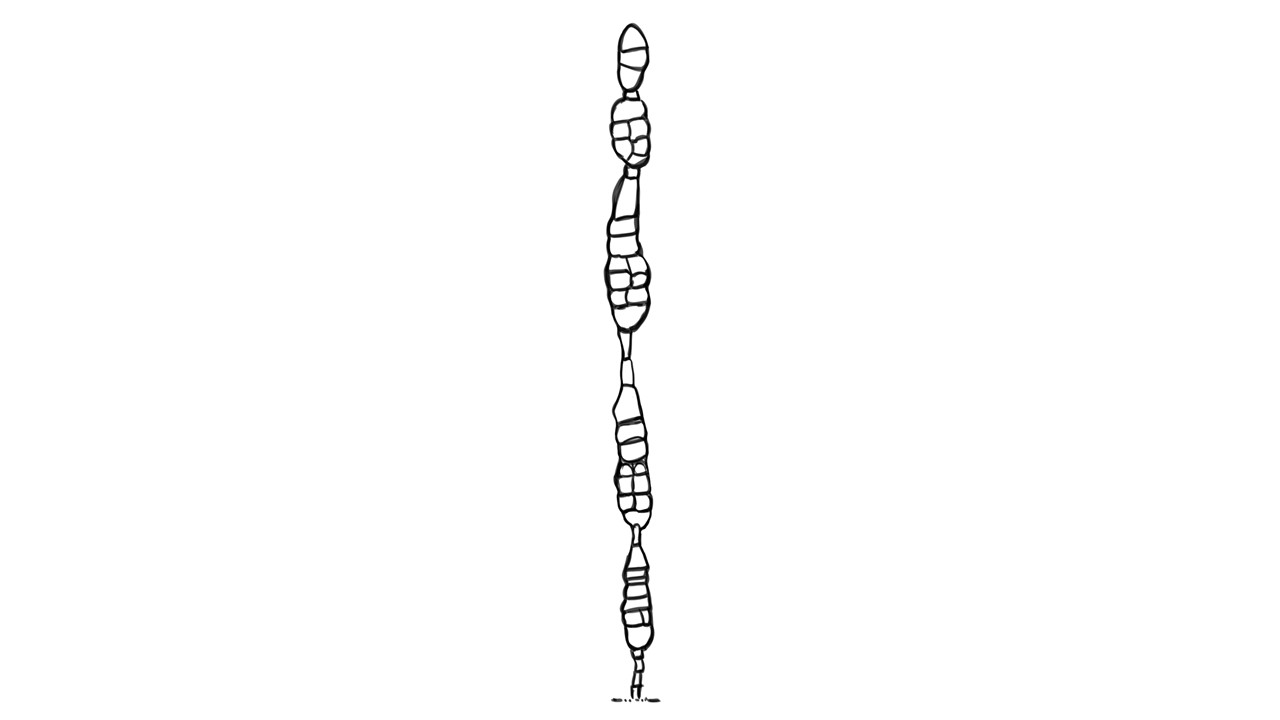
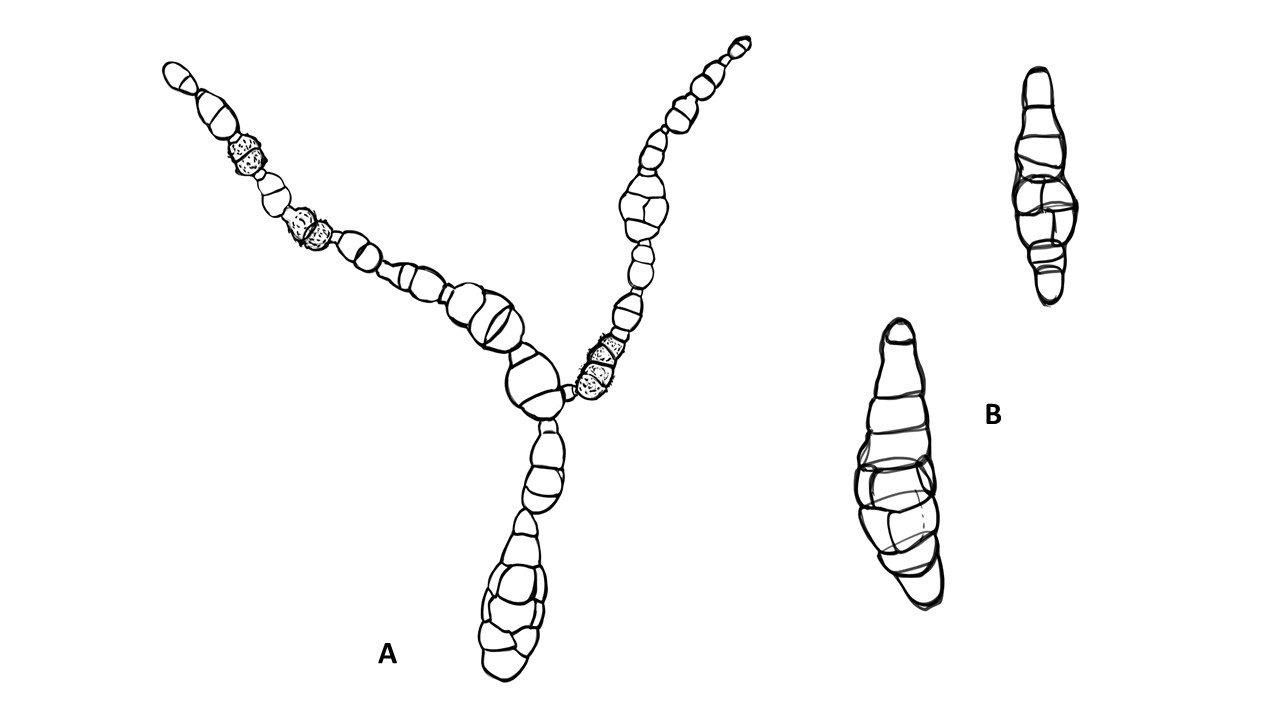
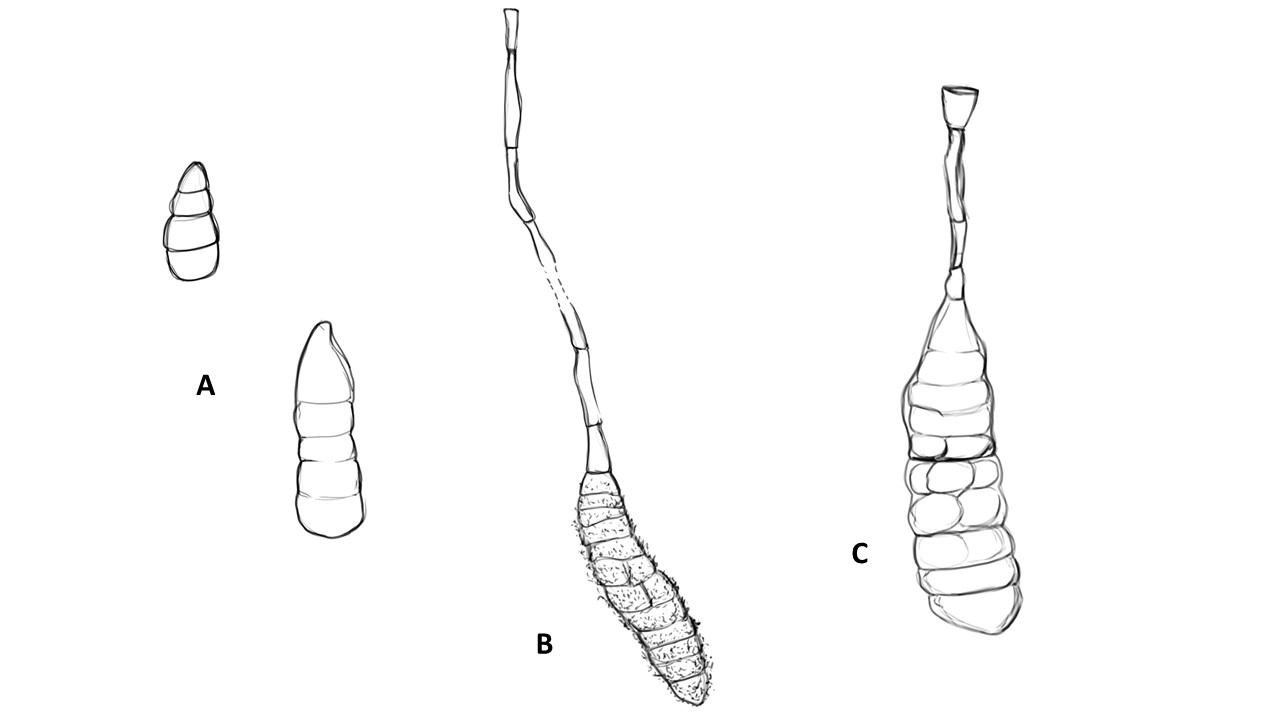
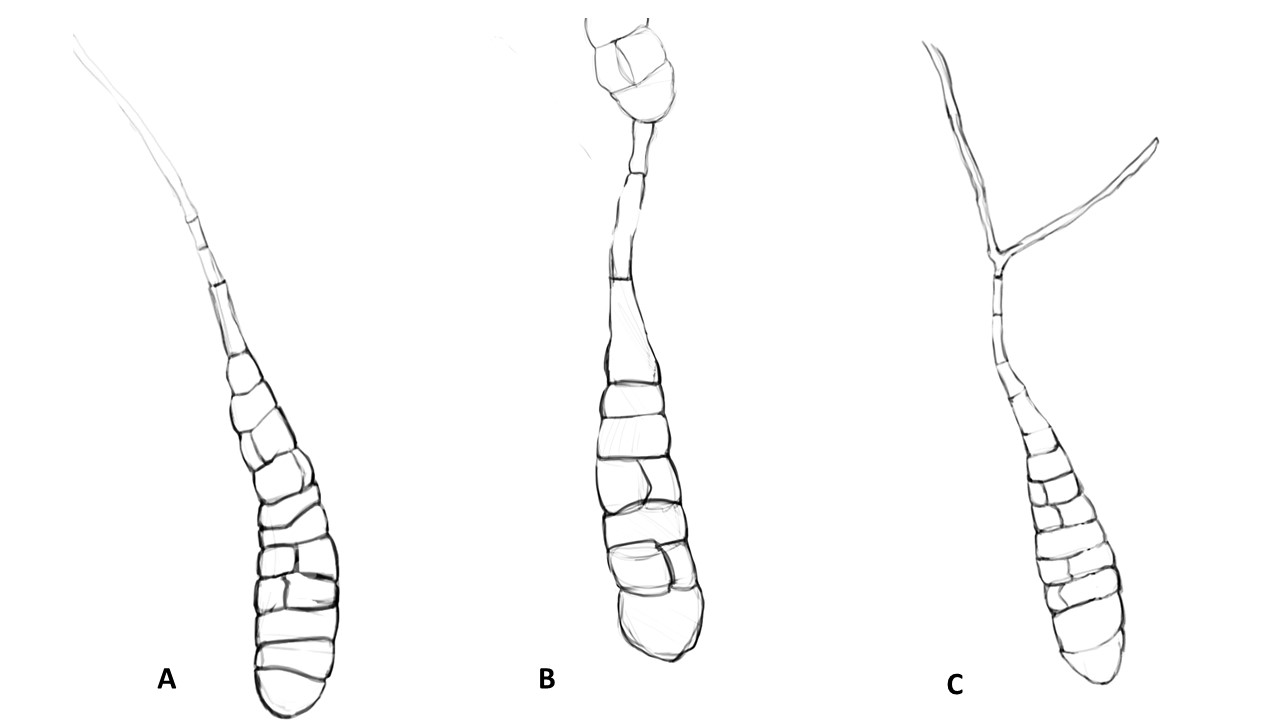
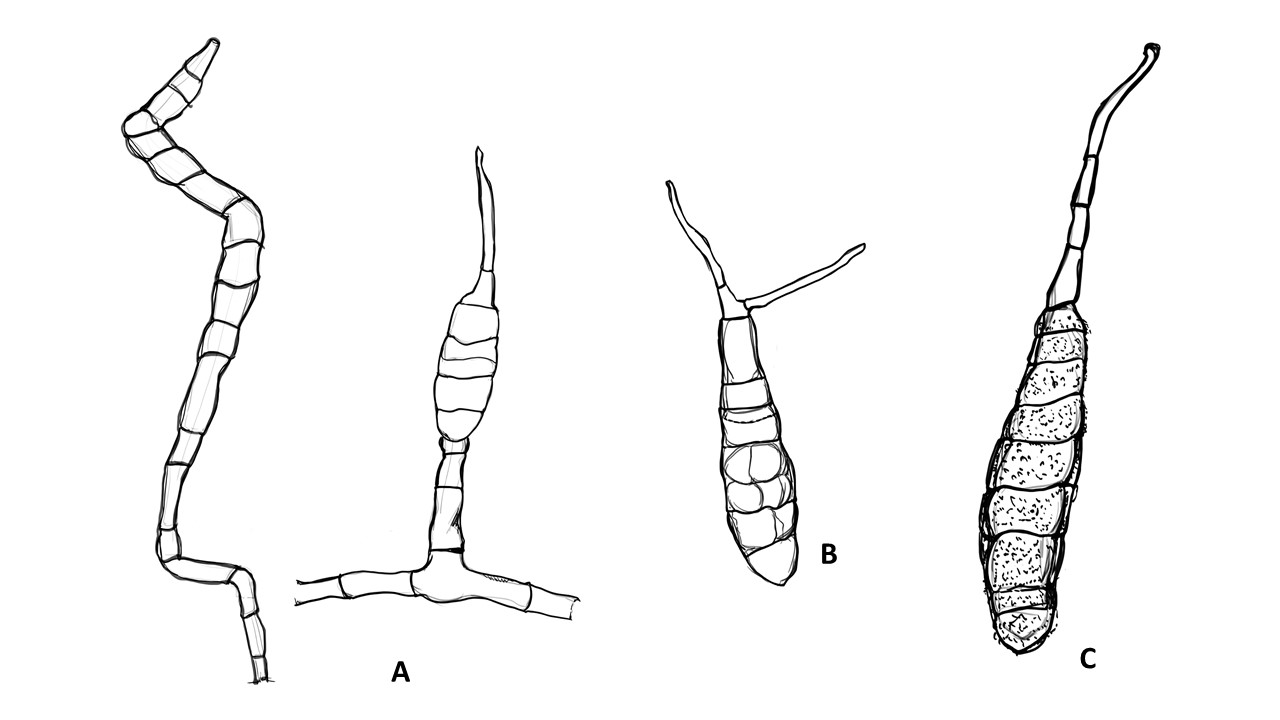
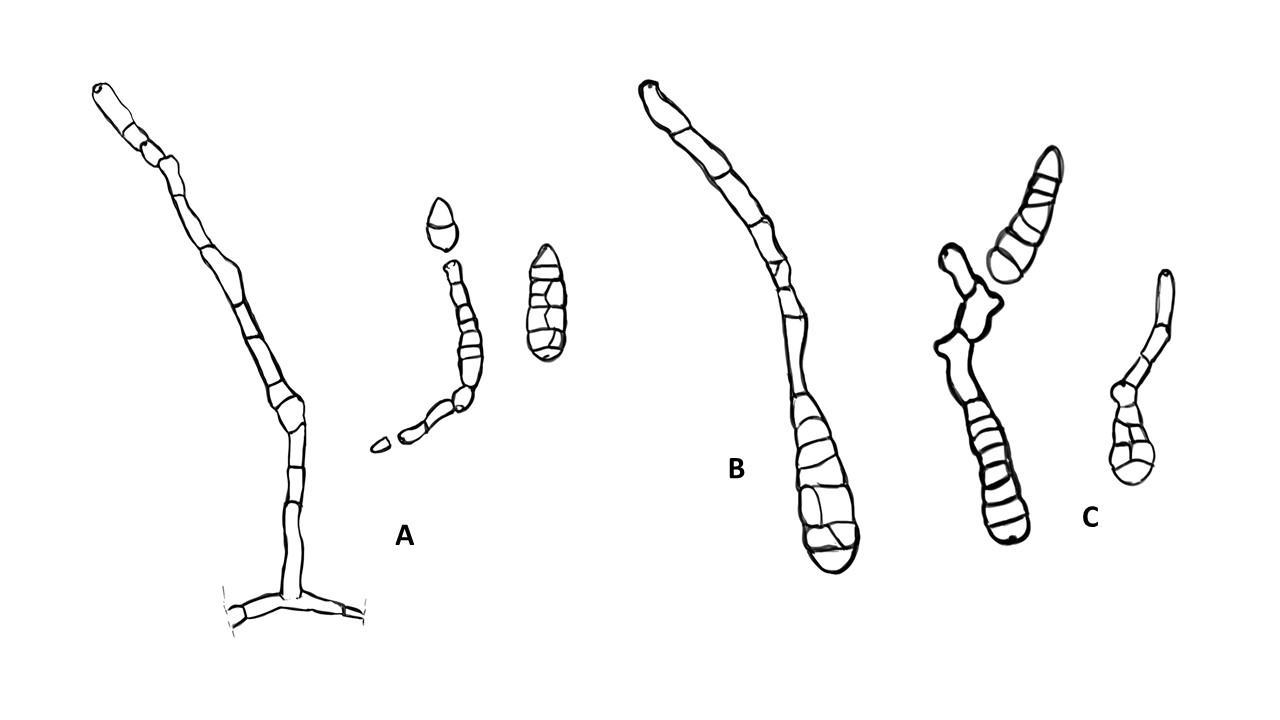
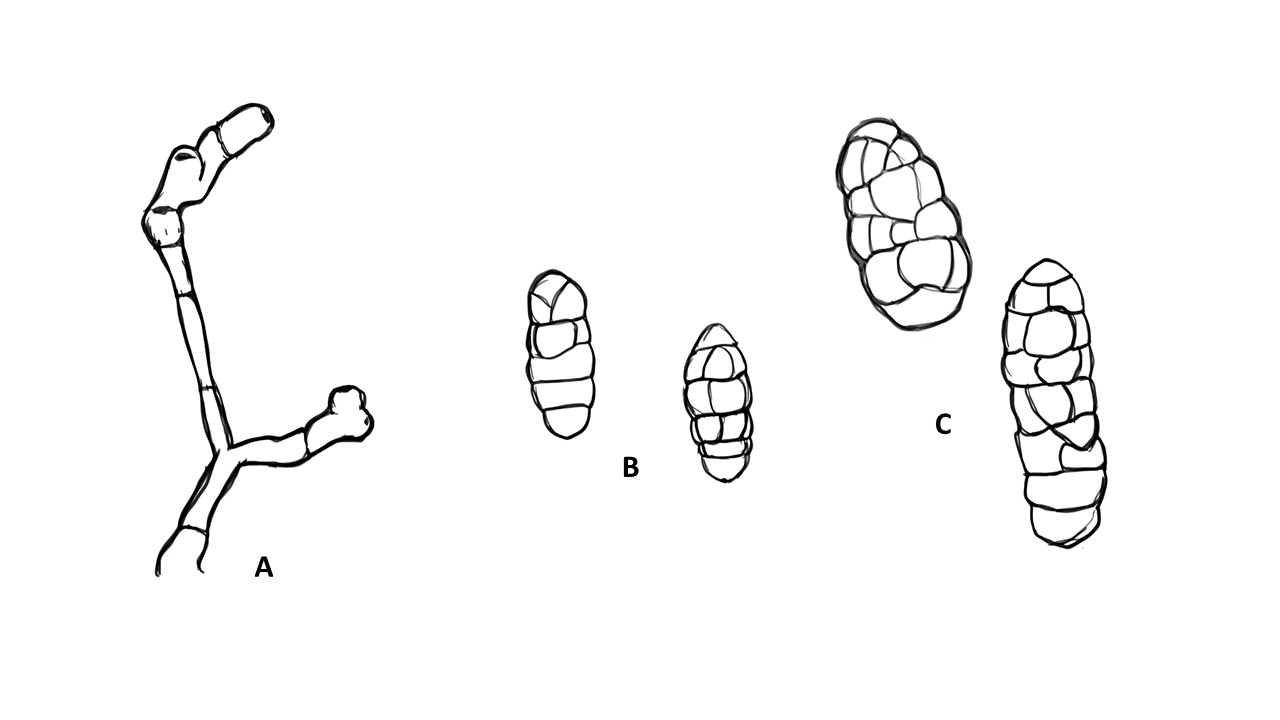
Conidióforo: macronematoso, morfológicamente se distingue de las hifas por presentar un pigmento más oscuro, solitario o formando grupos a partir de una base común. Es acroauxico, es decir presenta un crecimiento apical y simpodial dando una apariencia geniculada. Comúnmente no ramificado, en ocasiones con una rama o pocas ramas laterales.
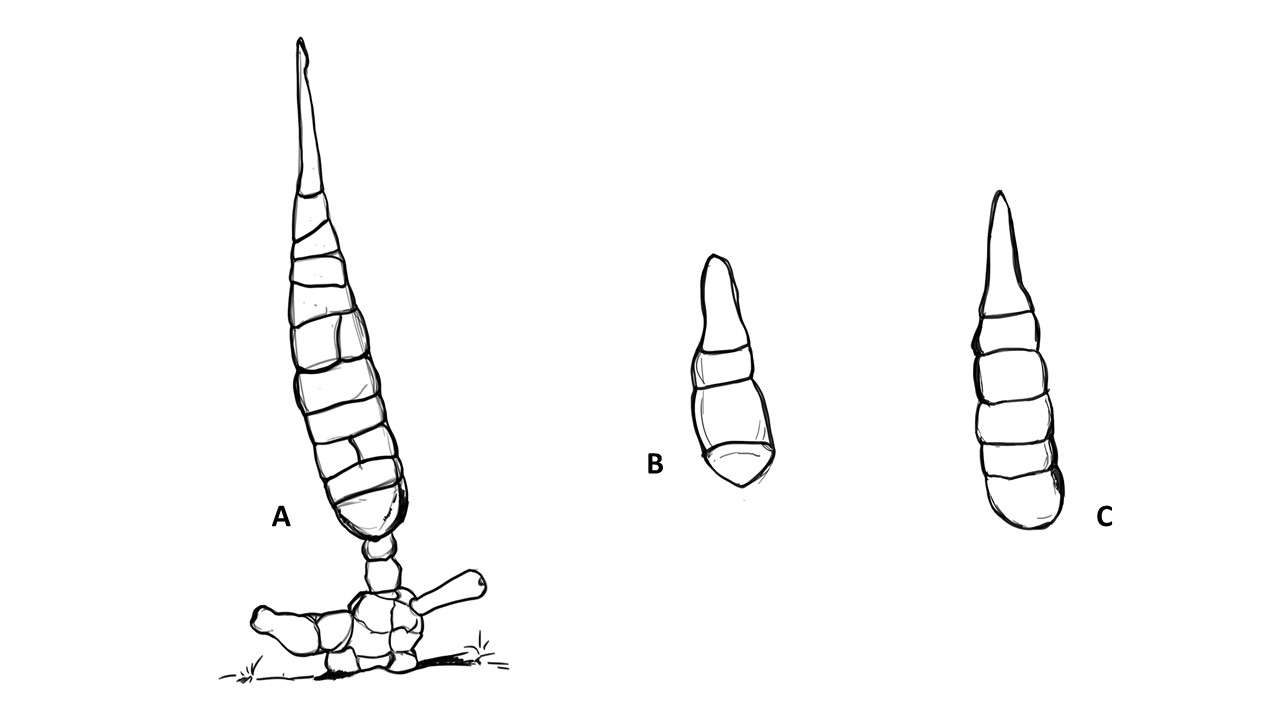
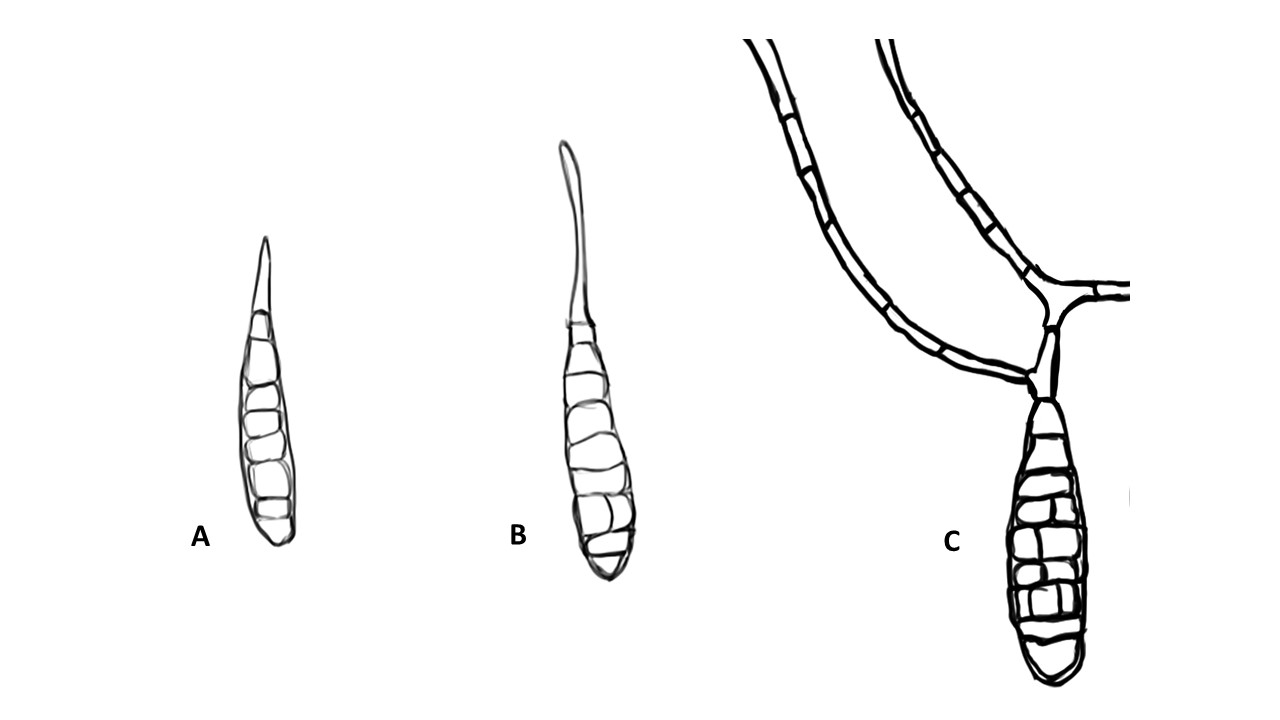
Conidios: se forman enteroblásticamente a través de poros en la pared del conidióforo, por lo que se les denomina poroconidios, generalmente forman conidios en cadenas con sucesión acrópeta, pero en ocasiones se forman de manera individual, en el ápice de los conidióforos. Son subesferoidales, ovoides o elipsoidales; multicelulares, con septos transversales y longitudinales, por lo cual se les denomina dictioconidios y por su color oscuro feosconidios. La célula apical del conidio llamada pico puede faltar, presentar una forma de uso romo, uso estrecho o filamentoso.
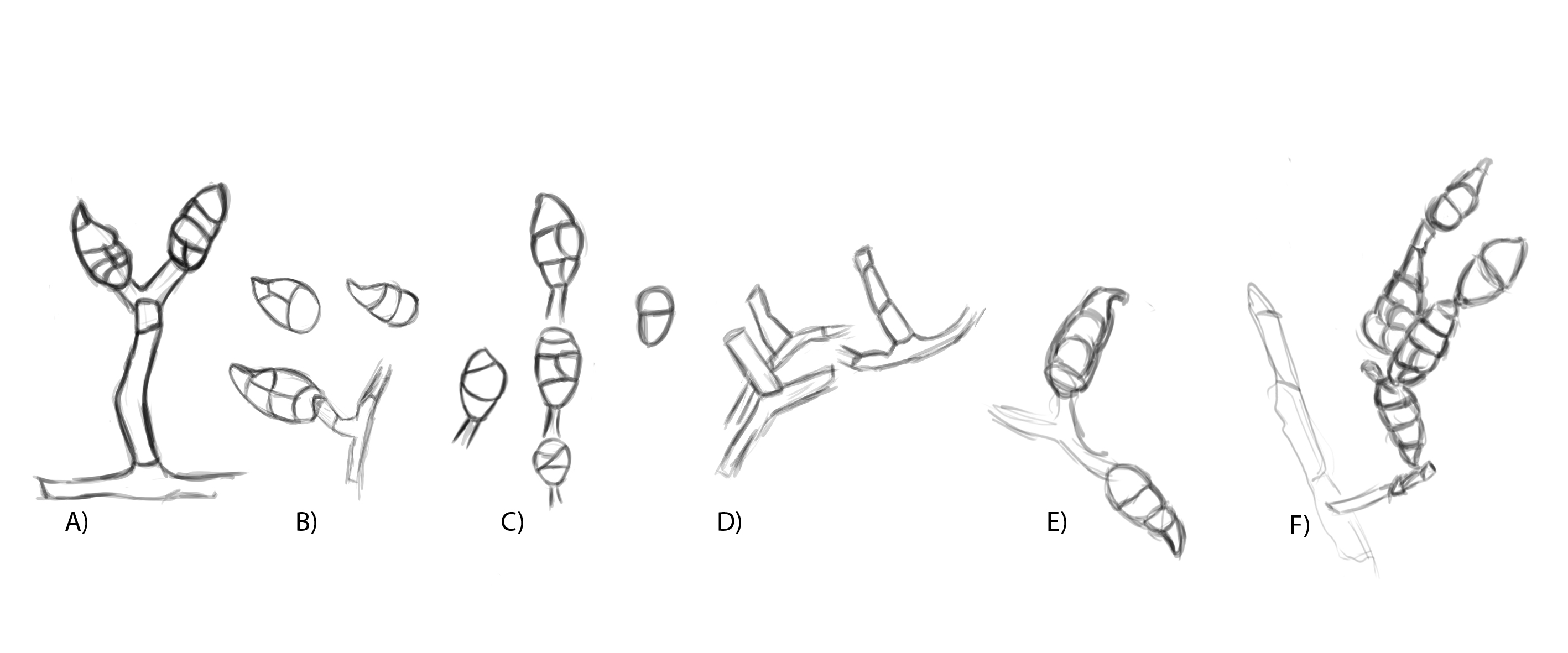
Figura 3. Morfología del género Alternaria. A) Conidióforo macronematoso con una rama dando origen a los poroconidios. B) Conidióforo corto no ramificado con un dictioconidio. C) Conidios con septos transversales, longitudinales y oblicuos. D) Conidiófororos a partir del micelio. E) Conidios con septos transversales. F) Conidios en cadenas con sucesión acrópeta.
Principales micotoxinas y su importancia
Se ha encontrado que el género Alternaria produce más de 70 metabolitos secundarios fitotóxicos, pero sólo algunos de ellos se han reportado con efectos tóxicos para el humano y animales. Algunos de estos metabolitos secundarios estudiados e identificados son el alternariol (AOH), el monometil-éter de alternariol (AME), el ácido tenuazónico (TeA), el altenueno (ALT) y las altertoxinas (ATX-I, -II, -III). Estas micotoxinas se pueden sintetizar en un amplio intervalo de temperaturas, pero con una actividad de agua (aw) alta, superior a 0.90, asimismo, la composición del sustrato es otro factor determinante en la producción de estas micotoxinas.
Alternariol, monometil éter de alternariol y altenueno
El AOH, AME y ALT son micotoxinas consideradas por su estructura química derivados de las dibenzo α pironas, el AOH y AME se ha demostrado que tienen efectos mutágenos, carcinógenos y citotóxicos en cultivos celulares de animales y bacterianos. Se han realizado pocos estudios con respecto a su efecto carcinógeno, sin embargo, se ha encontrado que en lugares donde se consumen granos con alta incidencia de especies del género Alternaria se ha asociado a la producción de cáncer de esófago. AOH y AME también han sido asociadas por afectar la proliferación celular y actividad metabólica de las células granulosas de porcinos, inhibiendo la producción de la hormona progesterona (P4), alterando el ciclo reproductivo en cerdos y otras especies de mamíferos (Tiemann et al., 2009). Ambas micotoxinas también causan efectos genotóxicos asociados a cáncer de colon al actuar sobre la actividad de las topoisomerasas, enzimas involucradas en la transcripción, replicación, condensación de los cromosomas e integridad del ADN (Fehr, et al., 2009). El AOH y AME han sido encontradas en frutas, hortalizas y sus derivados como son los tomates, aceitunas, manzanas, melones, frambuesas, mandarinas, en especias como pimienta, en semillas oleaginosas como el girasol, cacahuate, en granos de cereales y derivados, y bebidas alcohólicas. Con respecto a la micotoxina ALT se tiene poca información de sus efectos, algunos estudios han demostrado una toxicidad aguda baja y un efecto antimicrobiano de moderado a bajo.

Figura 4. Micotoxinas AOH, AME y ALT producidas por diversas especies de Alternaria, sustratos comunes y sus efectos en el ser humano y animales.
Altertoxinas
Las ATX son un derivado de las pirileno quinonas, presentan una actividad mutágena más potente que el AOH y AME, siendo la ATX-III la de mayor actividad. Asimismo, se ha demostrado que la ATX-I es absorbida por el lumen intestinal llegando a la circulación sanguínea y presenta un efecto sistémico, en el caso de la ATXII la absorción por el intestino es lenta, actúa principalmente a nivel del tracto digestivo (Fleck, et al., 2014). La ATXI y ATX-III son genotóxicas en cultivos celulares de ratón. Sin embargo, la presencia de estas toxinas es más limitada. La ATX-I ha sido determinada en sorgo, trigo, manzanas y oleaginosas.
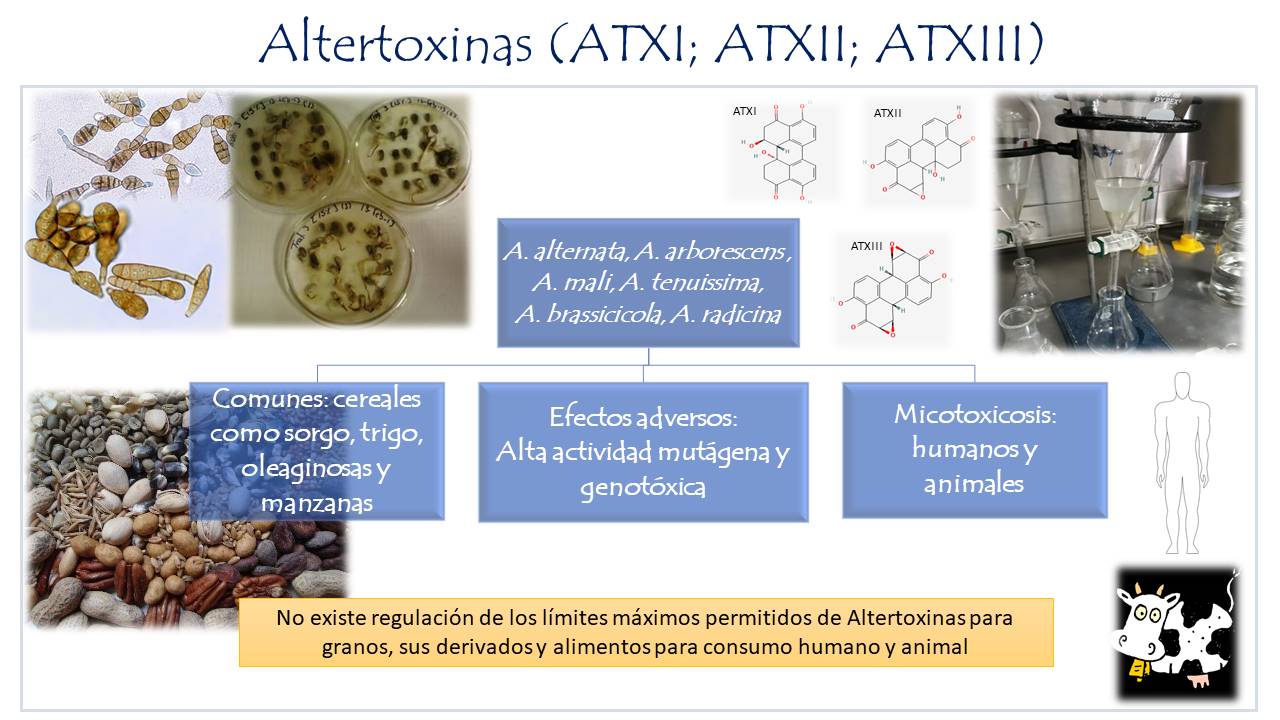
Figura 5. Altertoxinas producidas por diversas especies de Alternaria, sustratos comunes y sus efectos en el ser humano y animales.
Ácido tenuazónico
El TeA es un derivado del ácido tetrámico, no se han demostrado efectos mutagénicos en cultivos celulares bacterianos (Fleck, 2014), no obstante, su toxicidad en animales como ratones, pollos y perros provocan hemorragias en diversos órganos y en pollos efectos subagudos, al ser alimentados en dosis altas diarias (Pinto et al., 2007). Al igual que en AME se ha asociado por producir alteraciones en la mucosa esofágica en ratones alimentados, durante 10 meses diariamente con 25 mg/kg e inhibir la síntesis de proteínas en las células. También ha sido implicada esta micotoxina, como causante de un desorden hemorrágico en el humano conocido como Onyalai en África, por el consumo de sorgo contaminado con presencia de Phoma sorghina (Ostry, 2008). Se ha determinado en granos de cereales y derivados, en oleaginosas, aceites de semillas, frutas, legumbres y hortalizas, bebidas alcohólicas e incluso en alimentos infantiles.
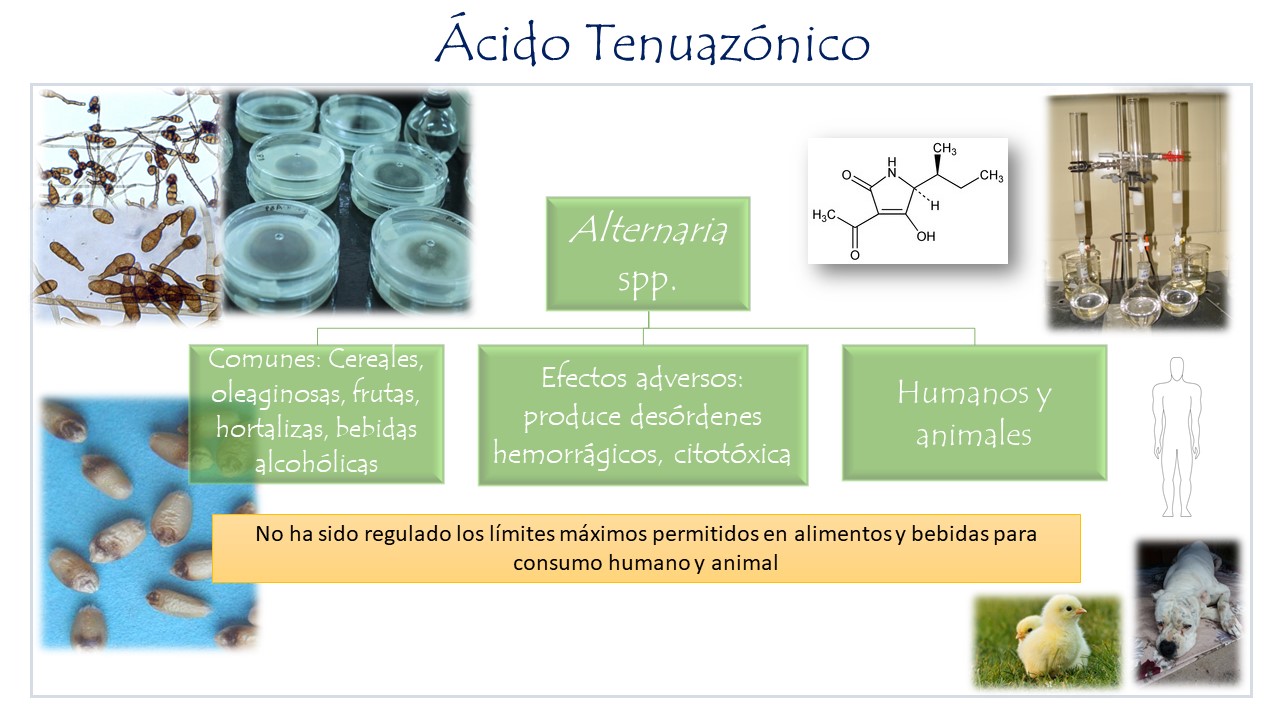
Figura 6. Ácido tenuazónico producido por diversas especies de Alternaria, sustratos comunes y sus efectos en el ser humano y animales.
Factores para la producción de micotoxinas de especies de Alternaria
El género Alternaria lo podemos encontrar viviendo como saprótrofo en el suelo, aire, en la superficie de las plantas o incluso como patógenos de plantas como las especies Alternaria alternata y A. triticina agentes causales de la punta negra en el grano de trigo, afectando su calidad desde el campo. Otras especies son agentes patógenos importantes de frutos y verduras como tomate, zanahoria, crucíferas, pudiéndose establecer durante el transporte o almacenamiento con refrigeración, causando enmohecimientos severos y pérdidas económicas importantes debido a que pueden crecer a bajas temperaturas. La actividad de agua (aw) y la temperatura se ha demostrado que son factores limitantes para la esporulación y síntesis de micotoxinas como AE, AME y AOH de Alternaria alternata siendo la temperatura de 25°C y una aw ˃ 0.97 las condiciones óptimas para la síntesis de las tres micotoxinas. La producción de TeA por A. alternata en sorgo in vitro se ha demostrado que la aw óptima es entre 0.90-0.93 y para semilla de algodón con A. tenuissima, bajo condiciones naturales, la biosíntesis es con una aw ˃90 y 20 °C. Es importante señalar que cuando las condiciones ambientales o un manejo inadecuado durante la cosecha, transporte, almacenamiento y elaboración de alimentos y bebidas con materia prima con una mala calidad sanitaria, se puede presentar el riesgo del desarrollo de mohos como especies del género Alternaria y contaminación con micotoxinas.