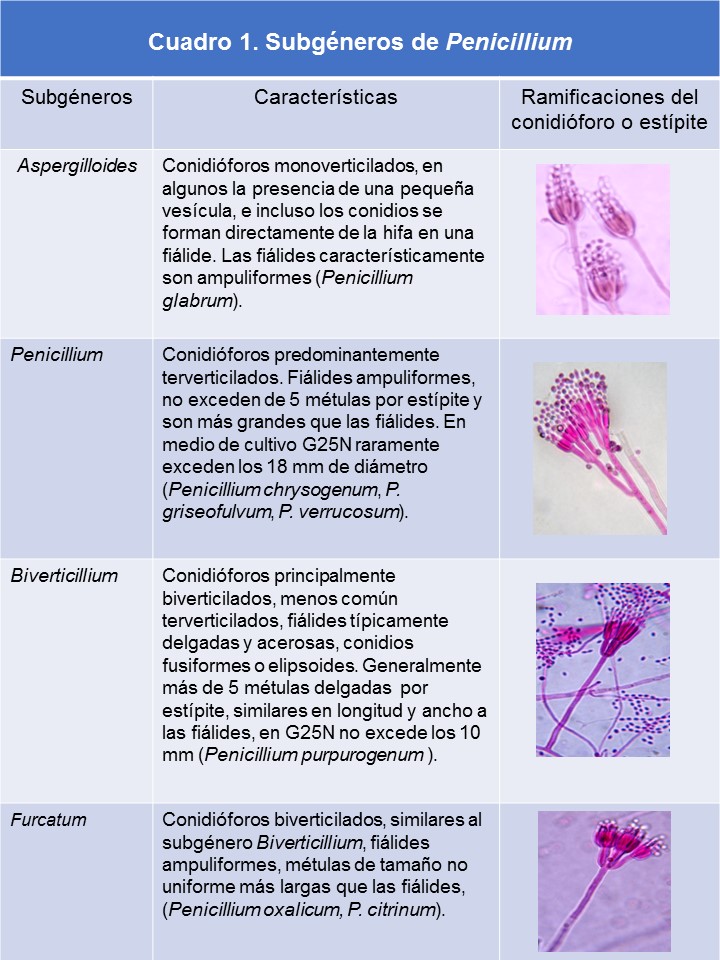
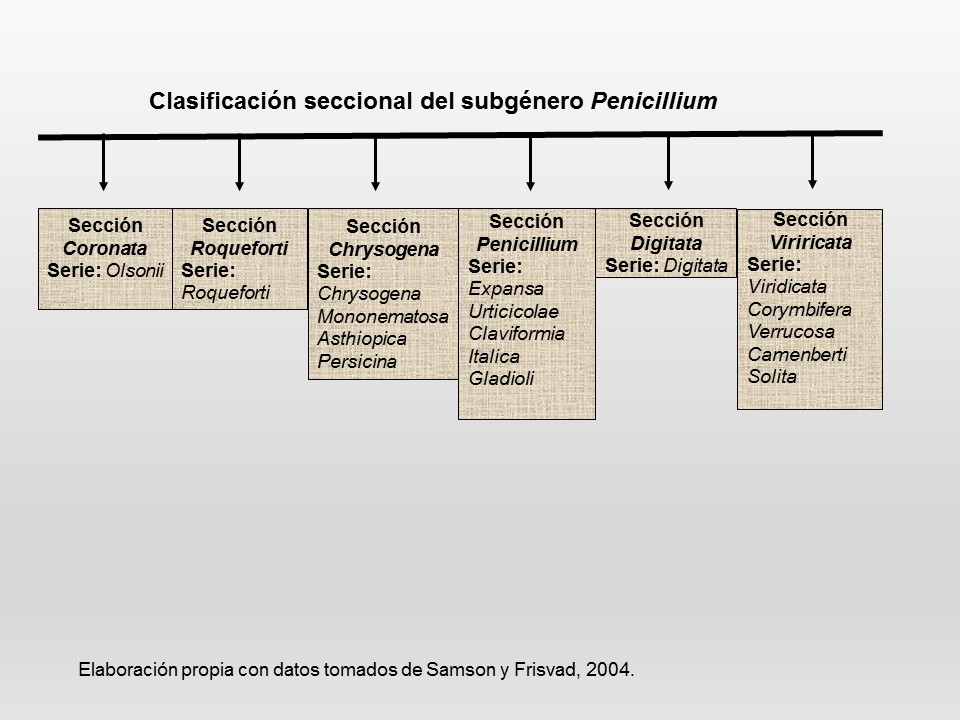
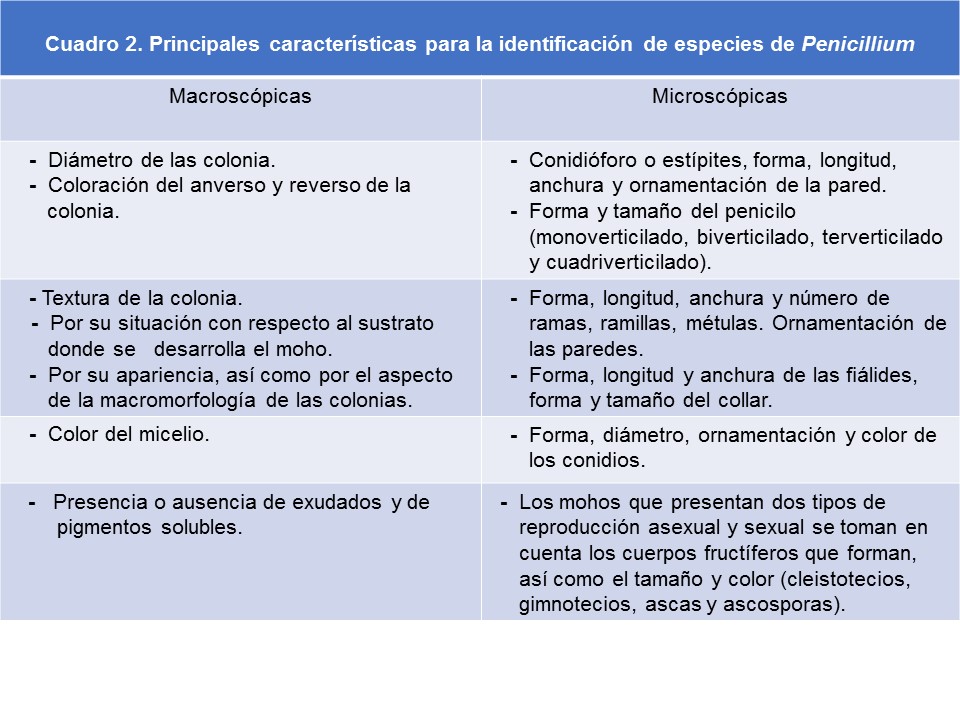
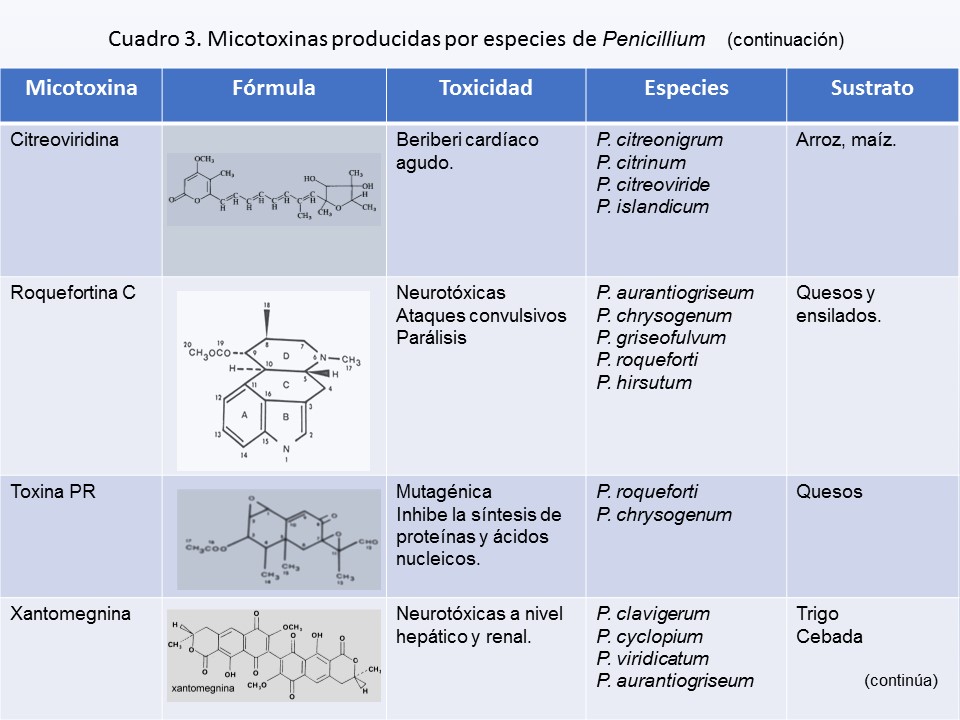
| 1a |
Colonias blancas o de color verde grisáceo muy pálido |
2 |
|
| 1b |
Colonias en algún tono de verde, a veces con micelio aéreo amarillo |
3 |
|
| 2a |
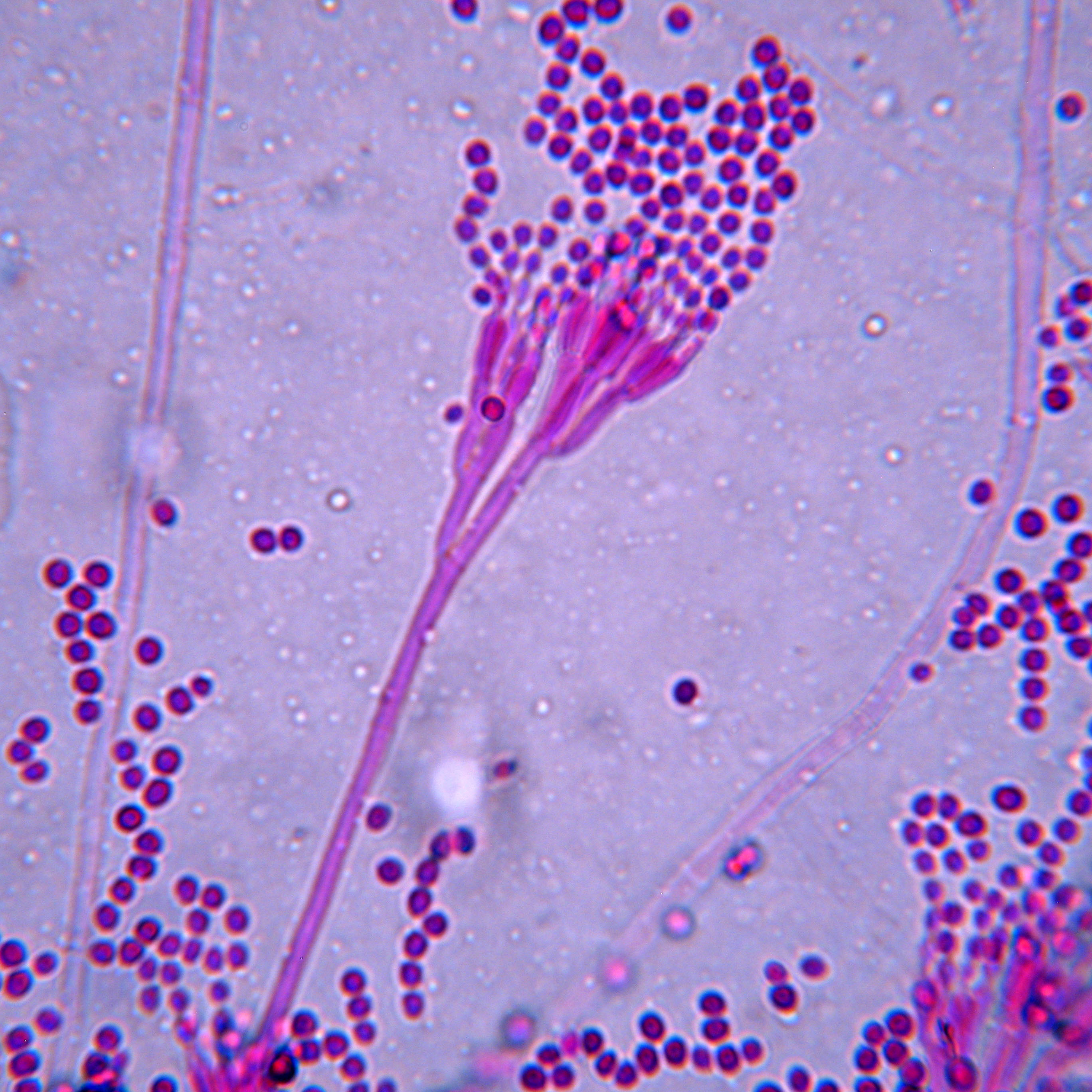
Conidióforos o estípites rugosos |
P. camemberti* |
|
| 2b |
Conidióforos o estípites lisos |
P. nalgiovense |
|
| 3a |
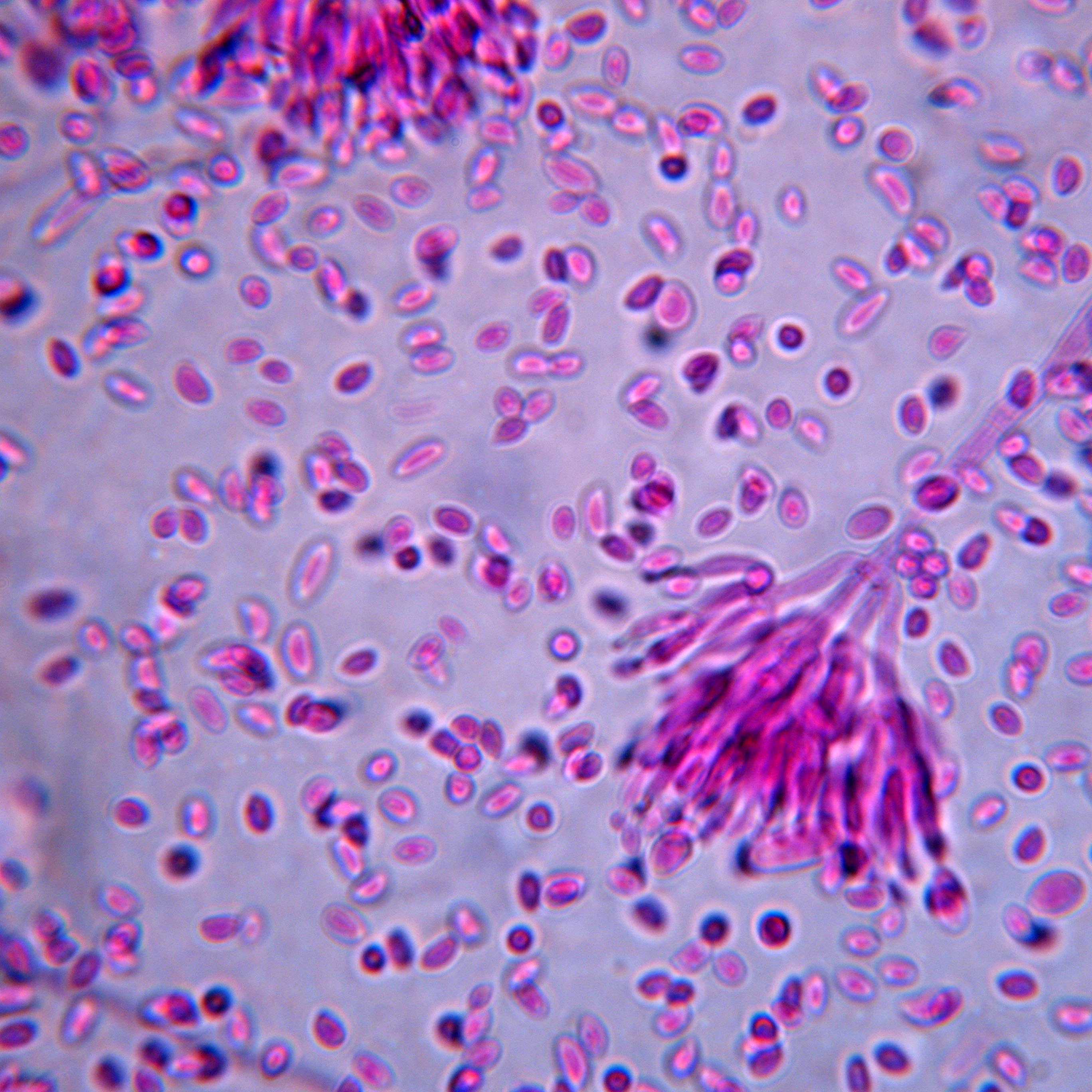
Colonias en Czapek agar (Cz) crecimiento y esporulación pobre (en CYA presenta un buen desarrollo), conidióforos cortos, con fiálides grandes (15-20 μm de largo) y conidios de elipsoidales a cilíndricos; responsable de la podredumbre de los cítricos |
P. digitatum |
|
| 3b |
Colonias en Cz y CYA presentan un abundante crecimiento y esporulación, conidióforos o estípites largos y fiálides generalmente más pequeñas (5-12 μm) |
4 |
|
| 4a |
Conidióforos monoverticilados (simples, no ramificados) |
P. glabrum |
|
| 4b |
Conidióforos ramificados |
5 |
|
| 5a |
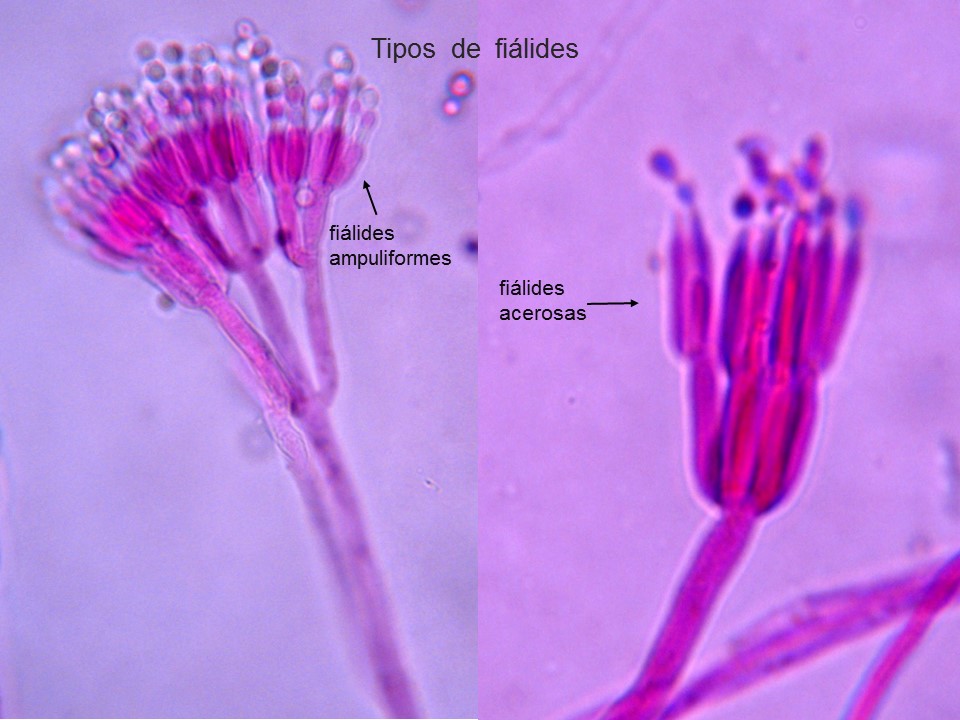
Fiálides acerosas (lanceoladas), conidióforos biverticilados, en ocasiones terverticilados |
6 |
|
| 5b |
Fiálides en forma ampuliforme, conidióforos biverticilados, terverticilados y cuadriverticilados |
9 |
|
| 6a |
Colonias que crecen rápidamente en MEA, en 7 días, alcanzan un diámetro de más de 15 mm |
7 |
|
| 6b |
Colonias pequeñas en MEA, menores a 15 mm de diámetro en una semana |
8 |
|
| 7a |
Colonias funiculosas, conidios subglobosos a elipsoidales, de 2.5-3.5 μm de largo |
P. funiculosum |
|
| 7b |
Colonias velutinosas, conidios grandes, elipsoidales, de 3.5-5 (7) μm de largo |
P. oxalicum |
|
| 8a |
Conidios rugosos y elipsoidales |
P. rugulosum |
|
| 8b |
Conidios lisos a rugosos, frecuentemente fusiformes |
P. variable |
|
| 9a |
Conidióforos predominantemente biverticilados |
10 |
|
| 9b |
Conidióforos terverticilados a cuadriverticilados |
11 |
|
| 10a |
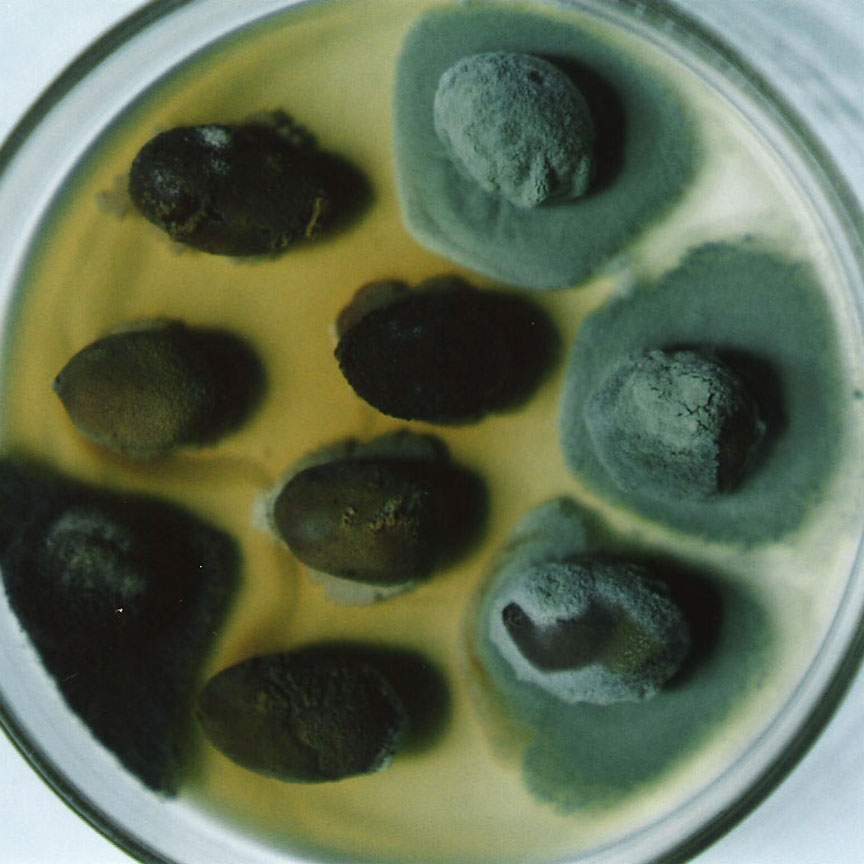
Colonias pequeñas en MEA, con un crecimiento menor a 15 mm de diámetro en una semana; el reverso de la colonia amarillo; métulas de 3-5 de igual longitud |
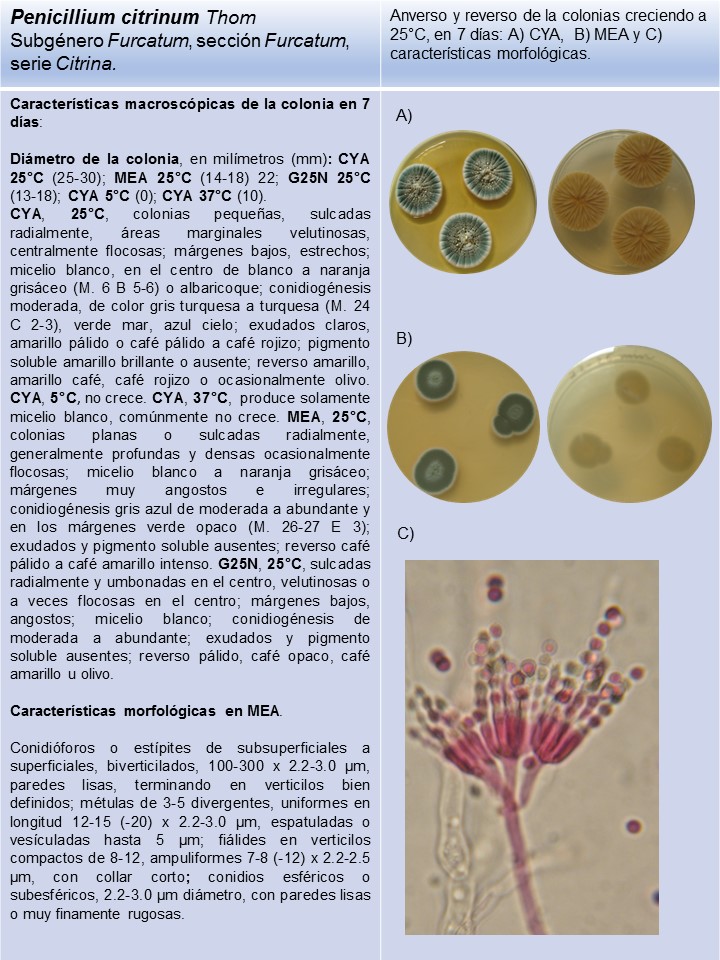
P. citrinum* |
Lámina 2
P. citrinum |
| 10b |
Colonias en MEA mayores a 15 mm de diámetro en una semana; reverso de la colonia verde oscuro a negruzco, después de 7 días; métulas de 2-4 por verticilo de diferente longitud |
P. corylophilum |
|
| 11a |
Conidióforos o estípites de paredes lisas en Cz y MEA, ocasionalmente rugosas en MEA |
12 |
|
| 11b |
Estípites o conidióforos tanto en Cz como en MEA finamente rugosos a distintivamente verrugosos |
17 |
|
| 12a |
Conidióforos o estípites largos de 500-2000 μm de longitud y de ancho de 4-6 μm presentando un desarrollo compacto |
13 |
|
| 12b |
Conidióforos o estípites cortos y de ancho de 2.5-4.0 μm |
14 |
|
| 13a |
Conidióforos o estípites hasta 800 μm de longitud, conidios globosos a subglobosos, colonias pequeñas |
P. brevicompactum* |
|
| 13b |
Conidióforos o estípites hasta 2000 μm de longitud, conidios elipsoidales, colonias grandes |
P. olsonii |
|
| 14a |
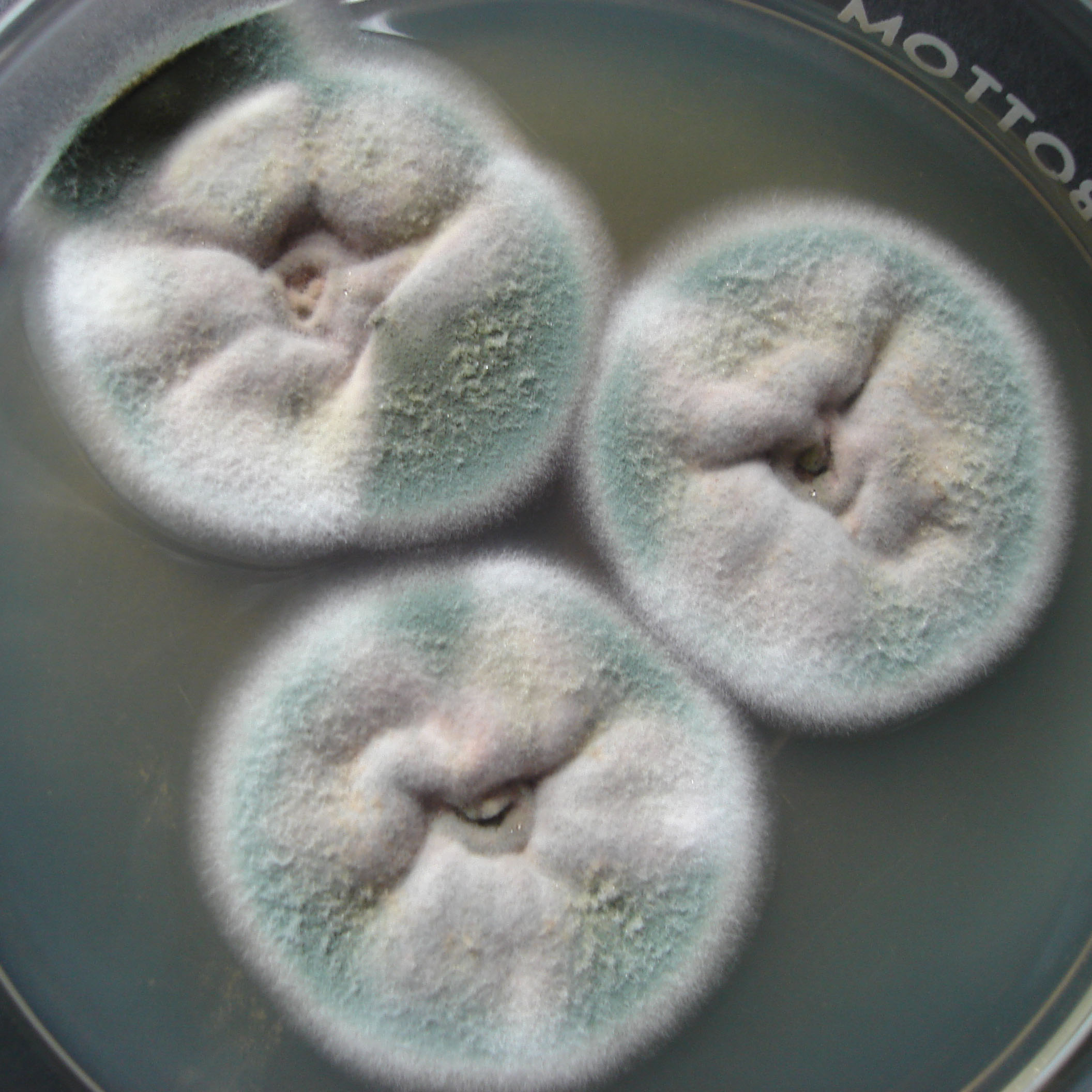
Colonias velutinosas con exudados presentes y el reverso a menudo amarillo; conidios globosos a elipsoidales |
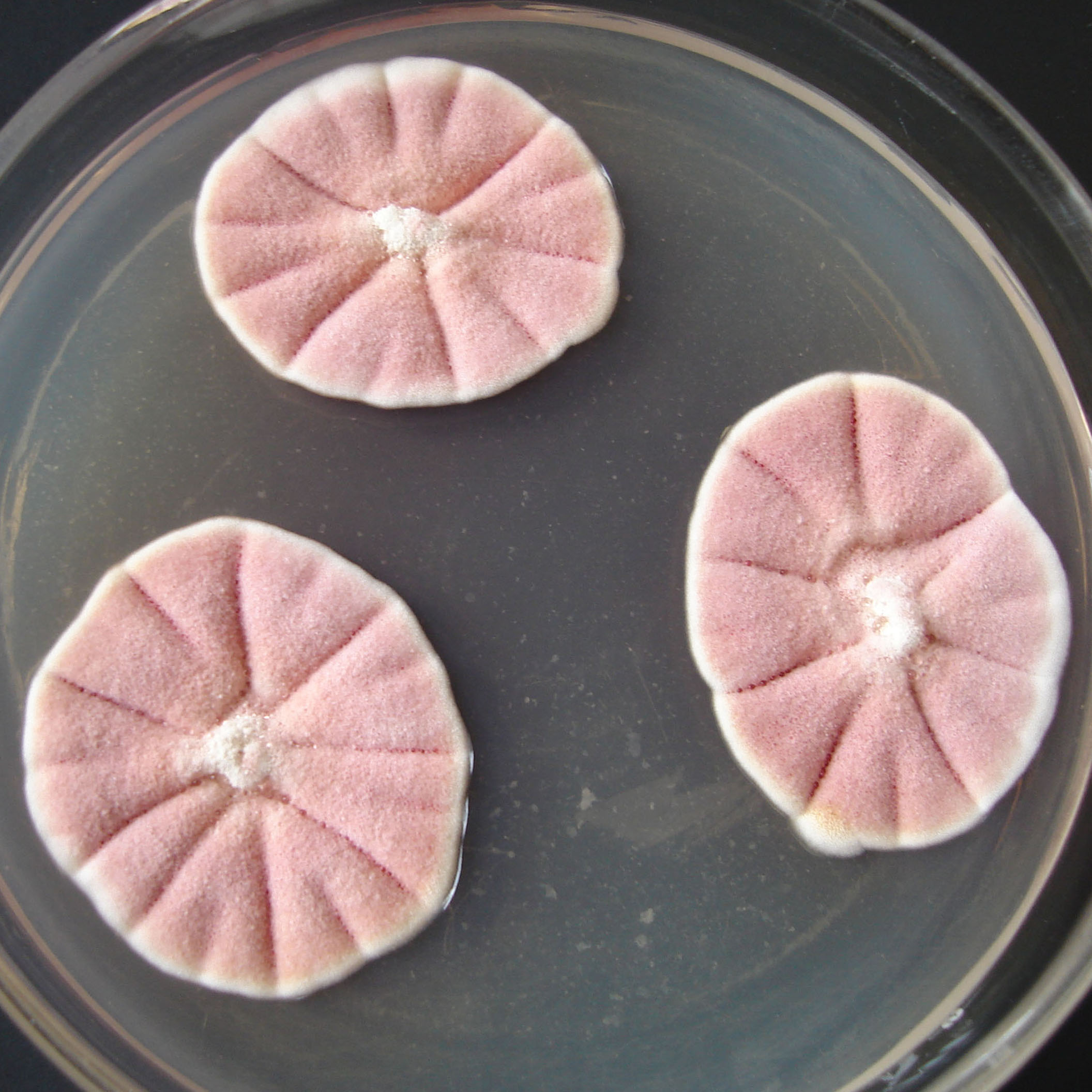
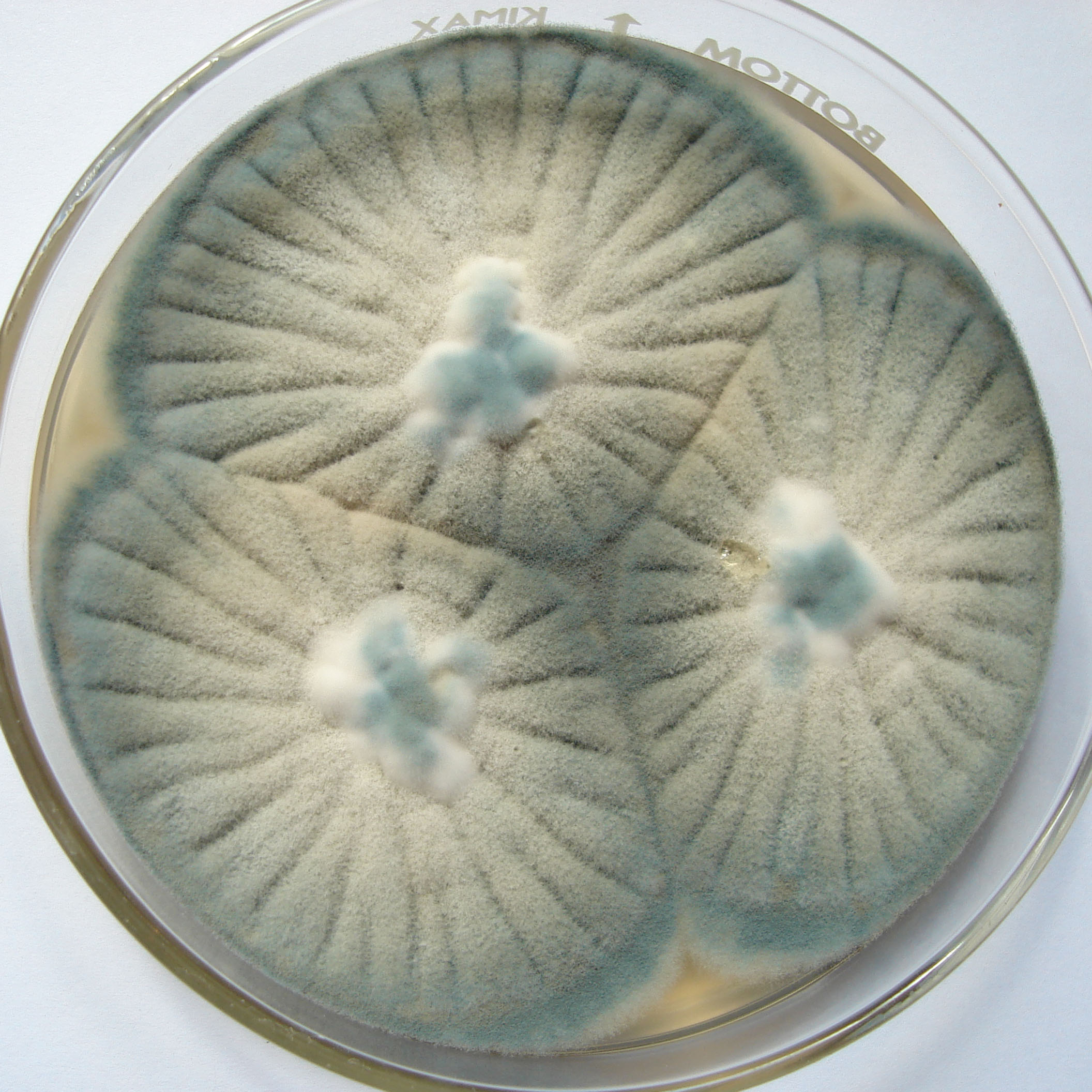
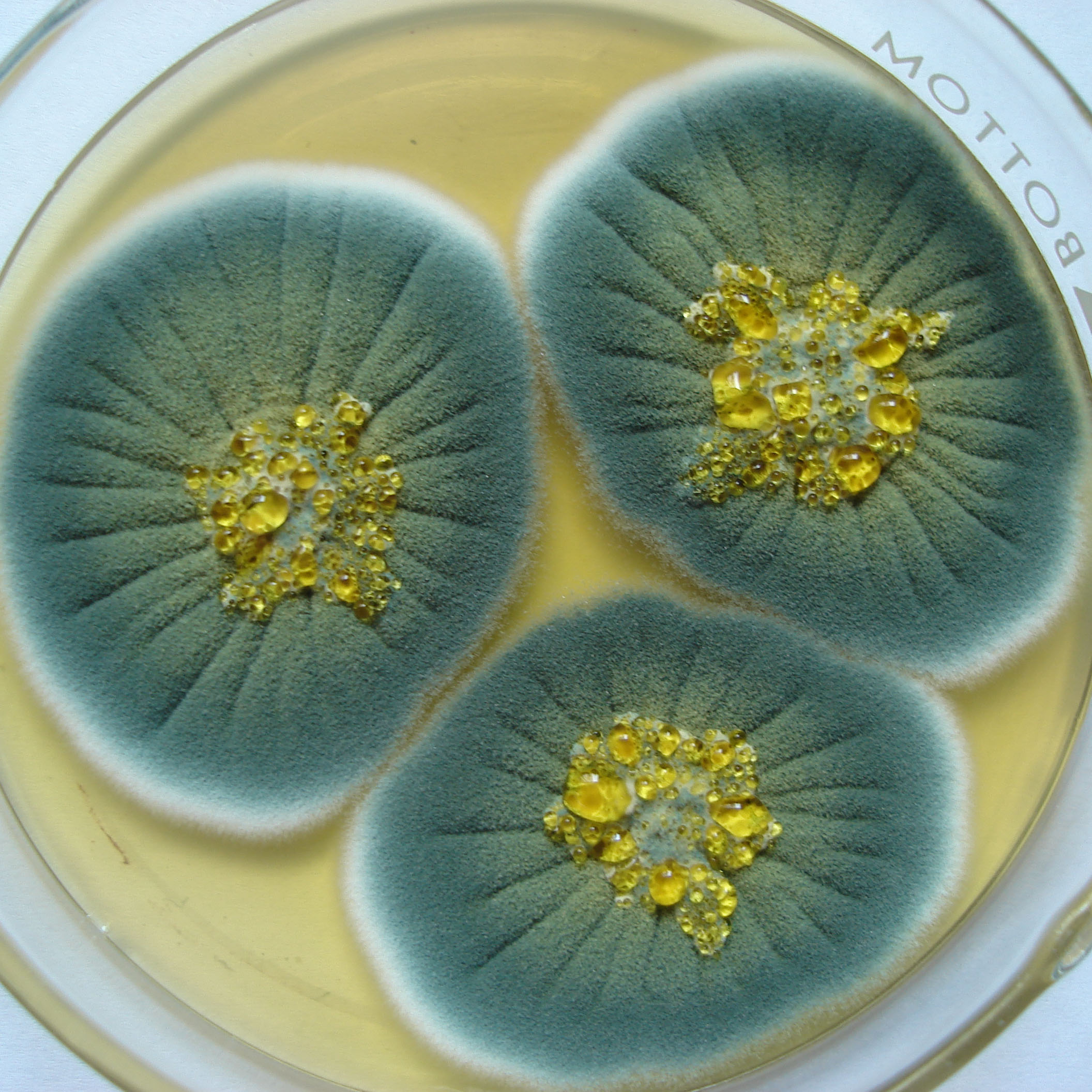
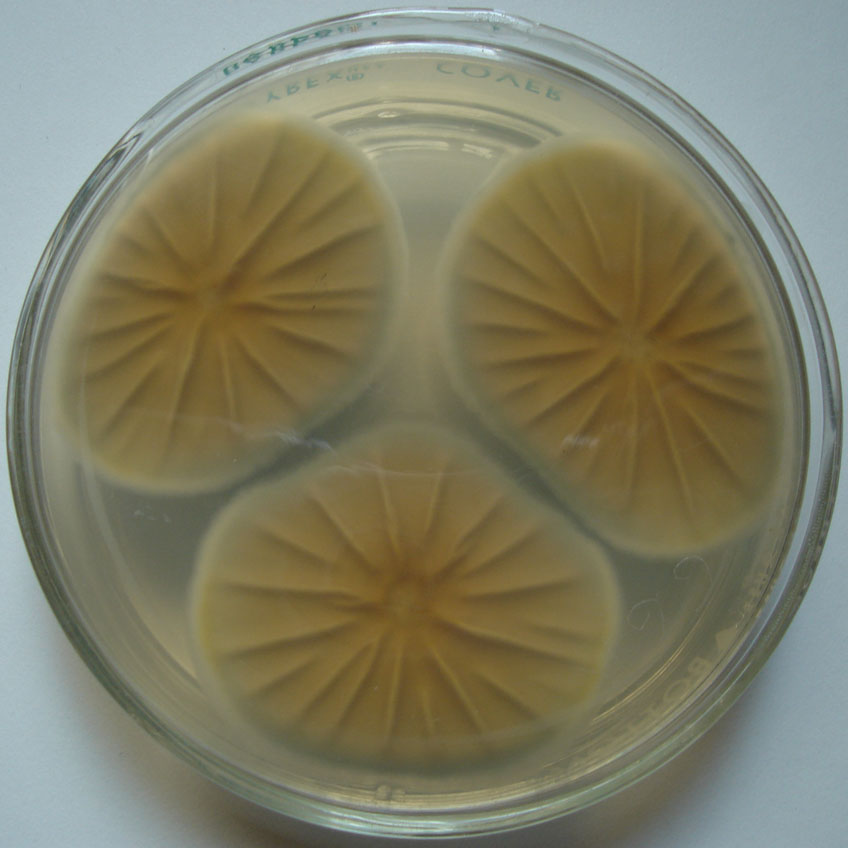
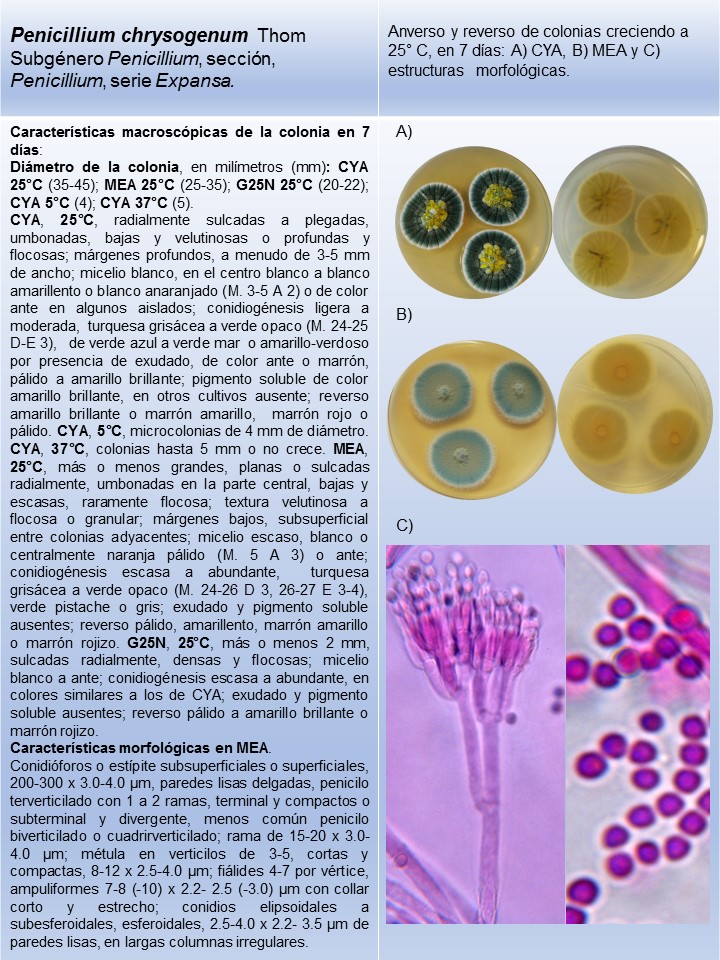
P. chrysogenum* |
Lámina 1
P. chrysogenum |
| 14b |
Colonias con conidióforos agregados formando fasciculalos, exudados escasos de color amarillo; conidios subglobosos, elipsoidales a cilíndricos |
15 |
|
| 15a |
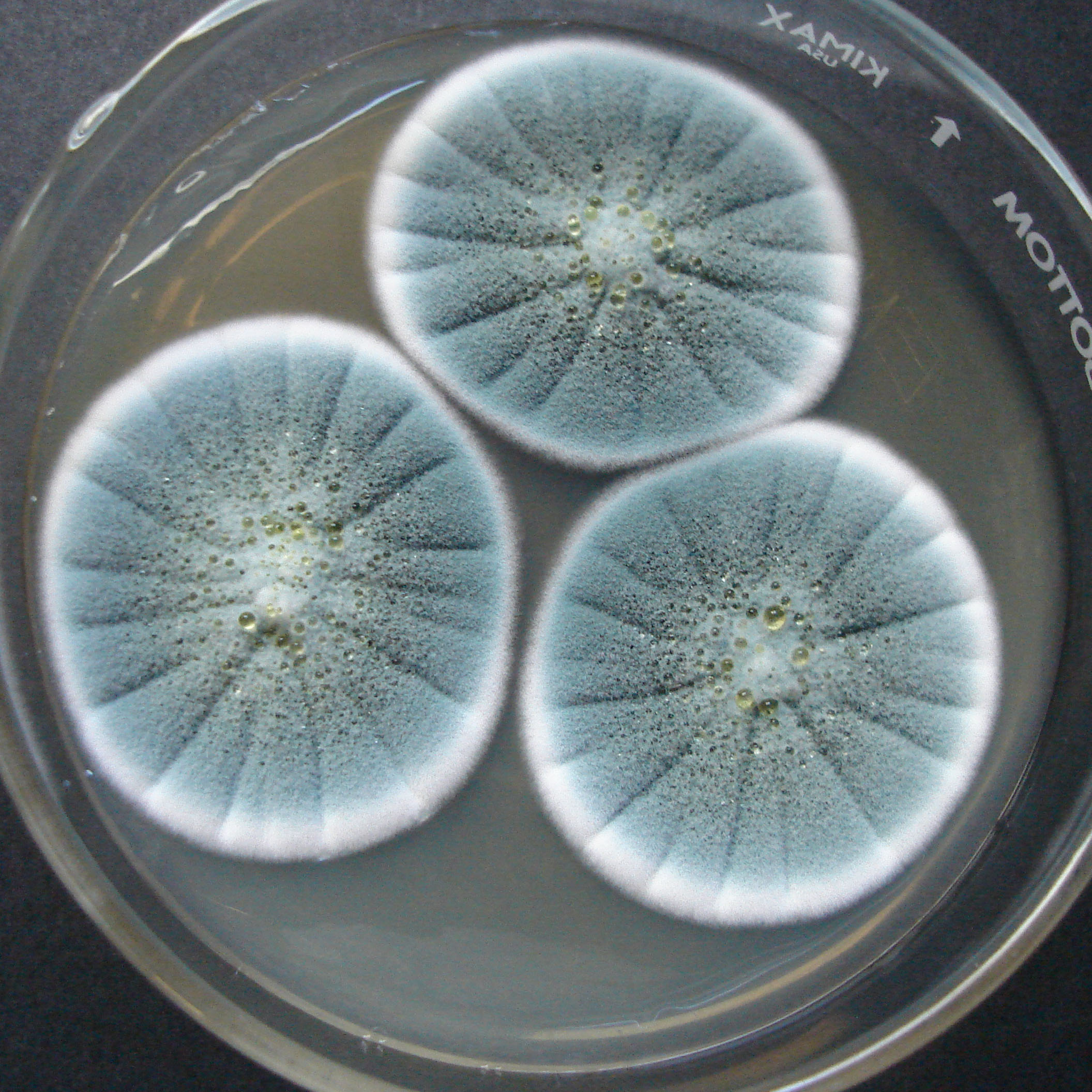
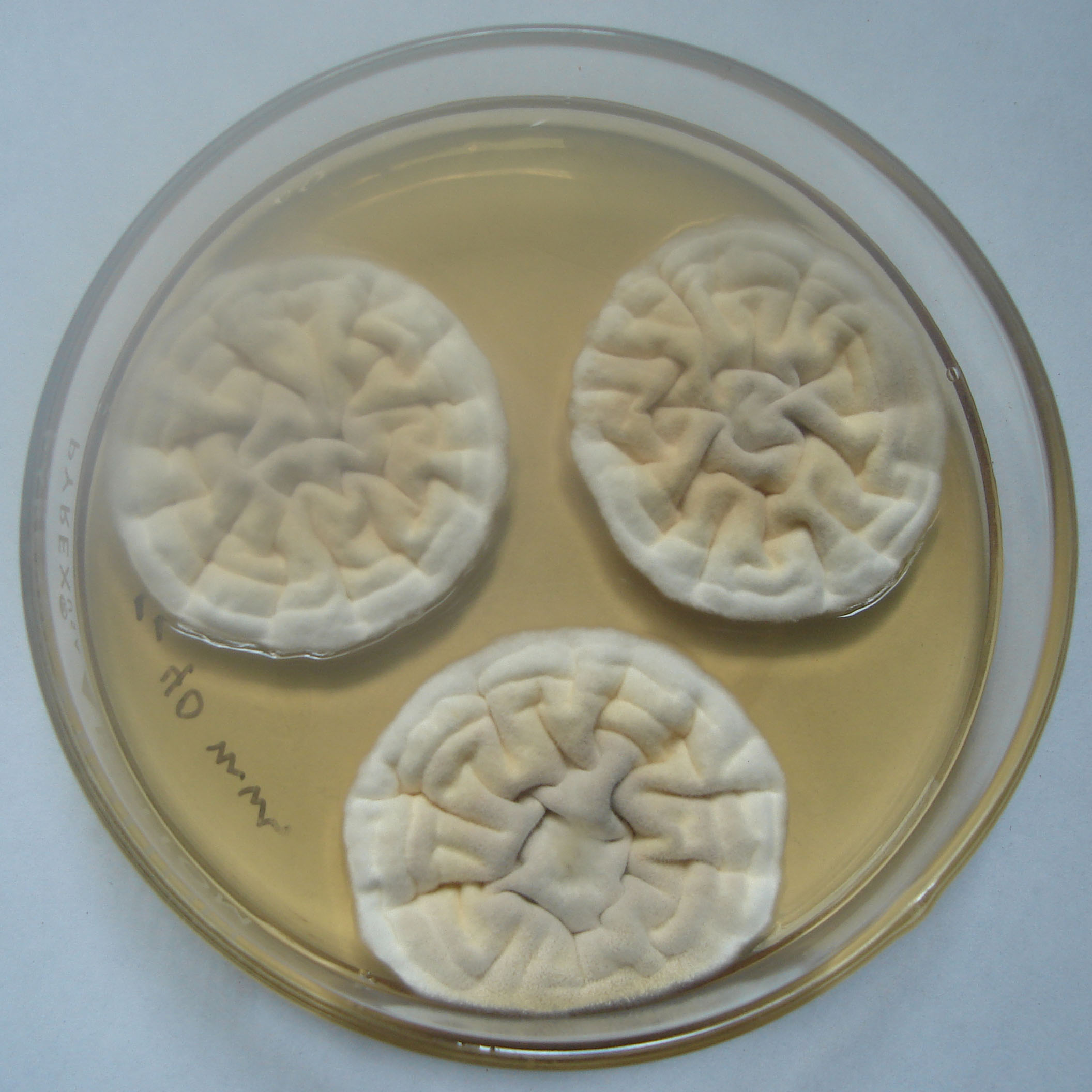
Fiálides pequeñas, menores de 6.5 μm de largo, conidióforos a menudo cuadriverticilados |
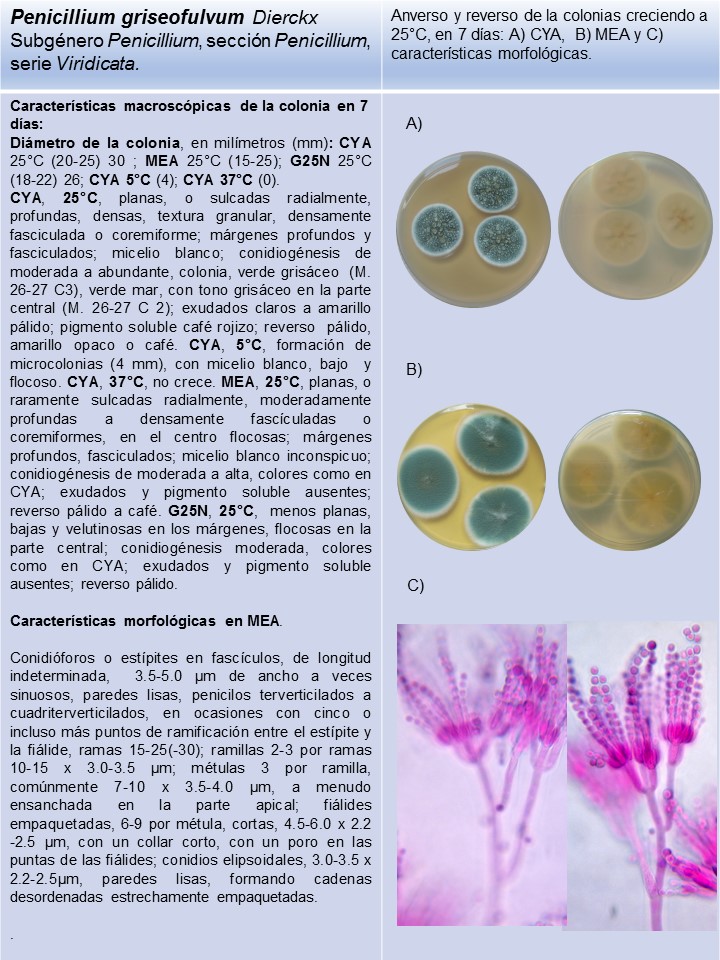
P. griseofulvum*
|
Lámina 7
P. griseofulvum |
| 15b |
Fiálides más largas de 6.5 μm, conidióforos terverticilados |
16 |
|
| 16a |
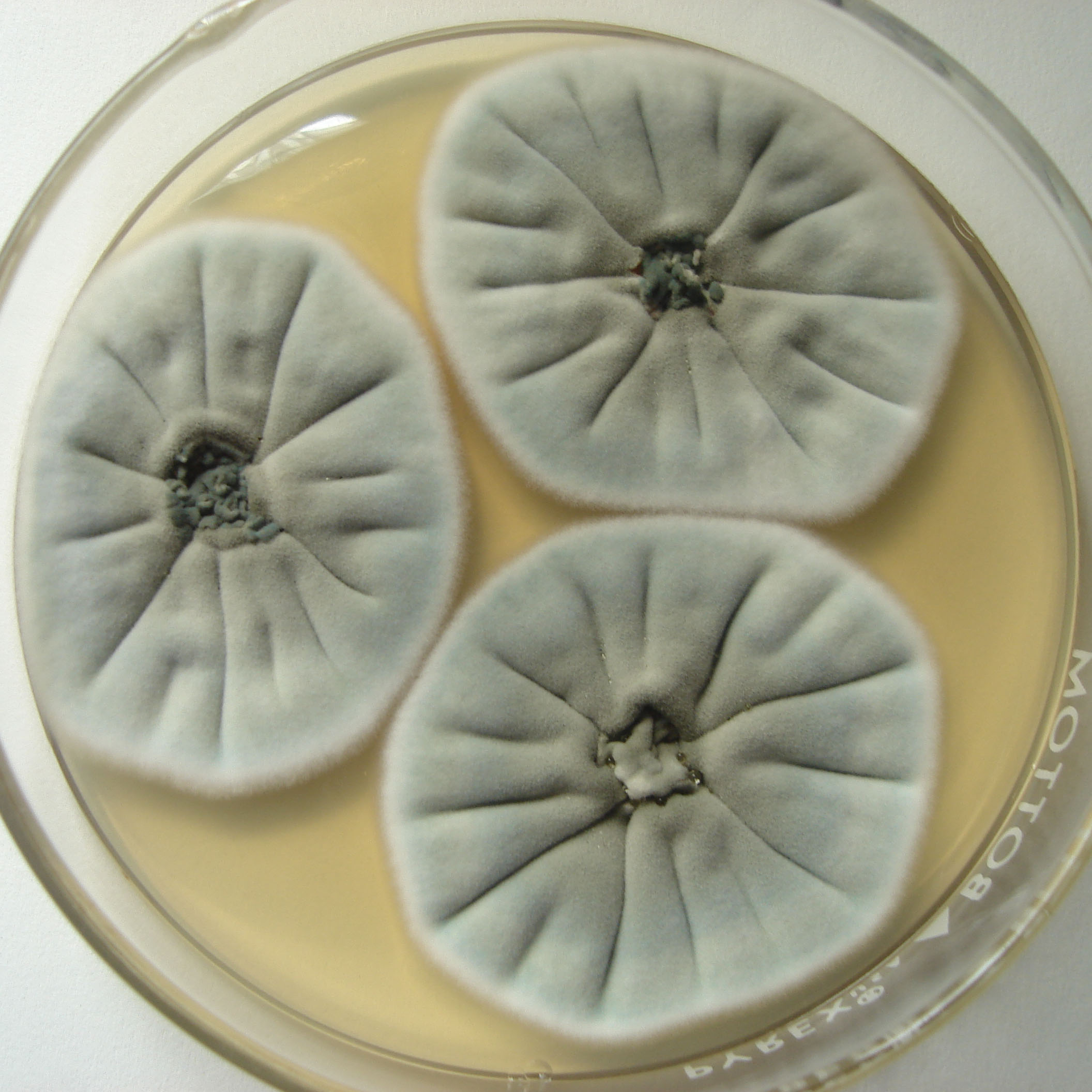
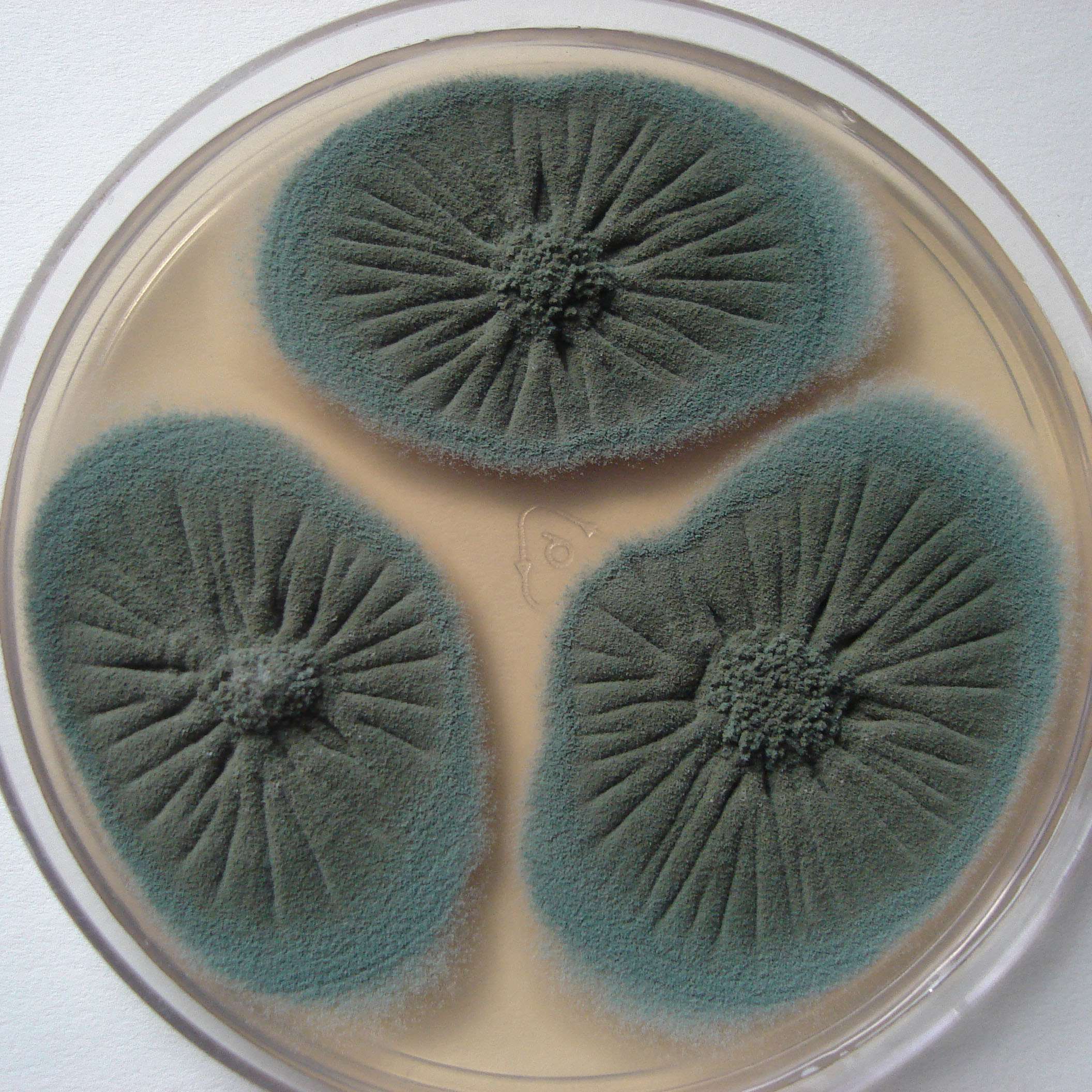
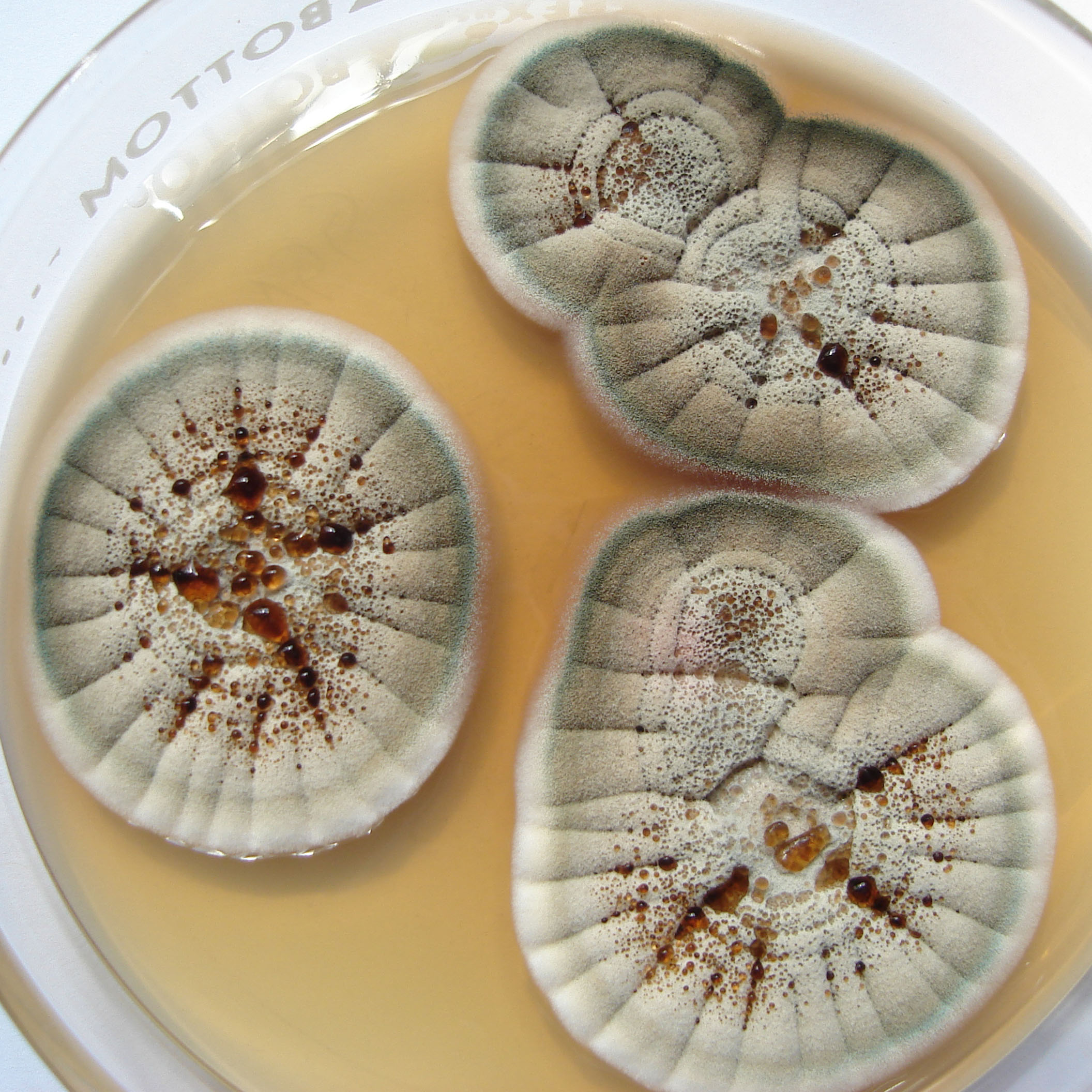
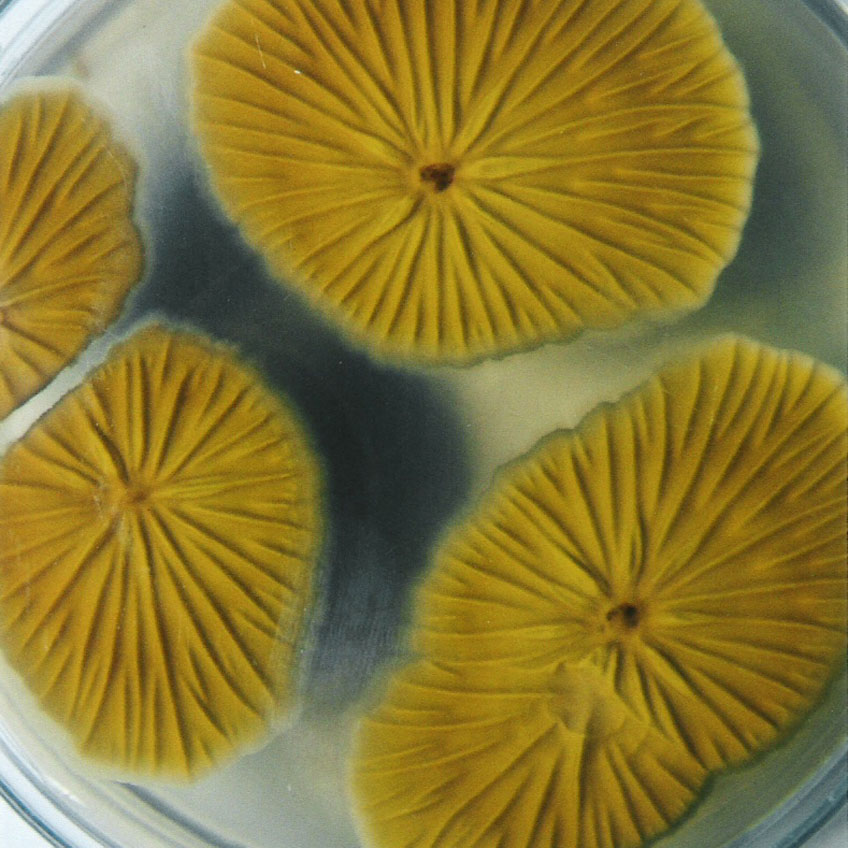
Colonias de 40-50 mm de diámetro a los 14 días; conidios subglobosos a elipsoidales; responsables de la putrefacción de los frutos pomáceos |
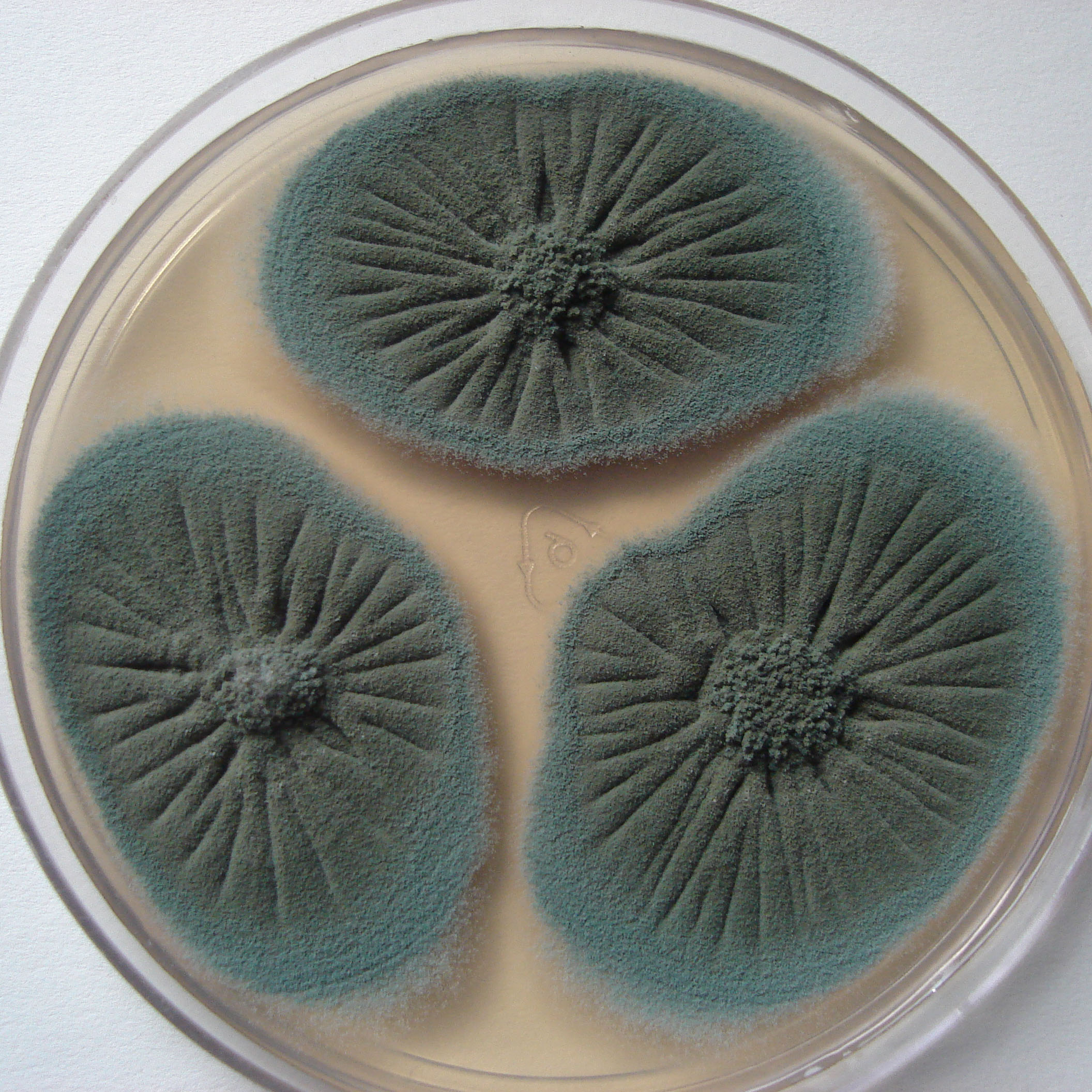
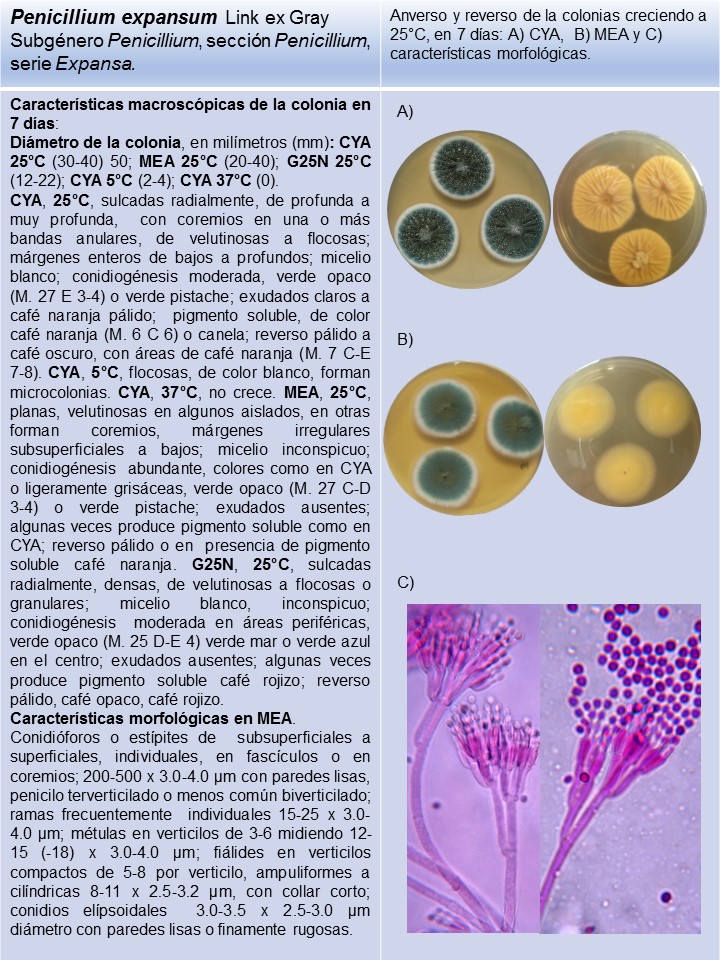
P. expansum* |
Lámina 3
P. expansum |
| 16b |
Colonias 20-25 mm de diámetro a los14 días; conidios de elipsoidales a cilíndricos; responsable de la podredumbre de los cítricos |
P. italicum |
|
| 17a |
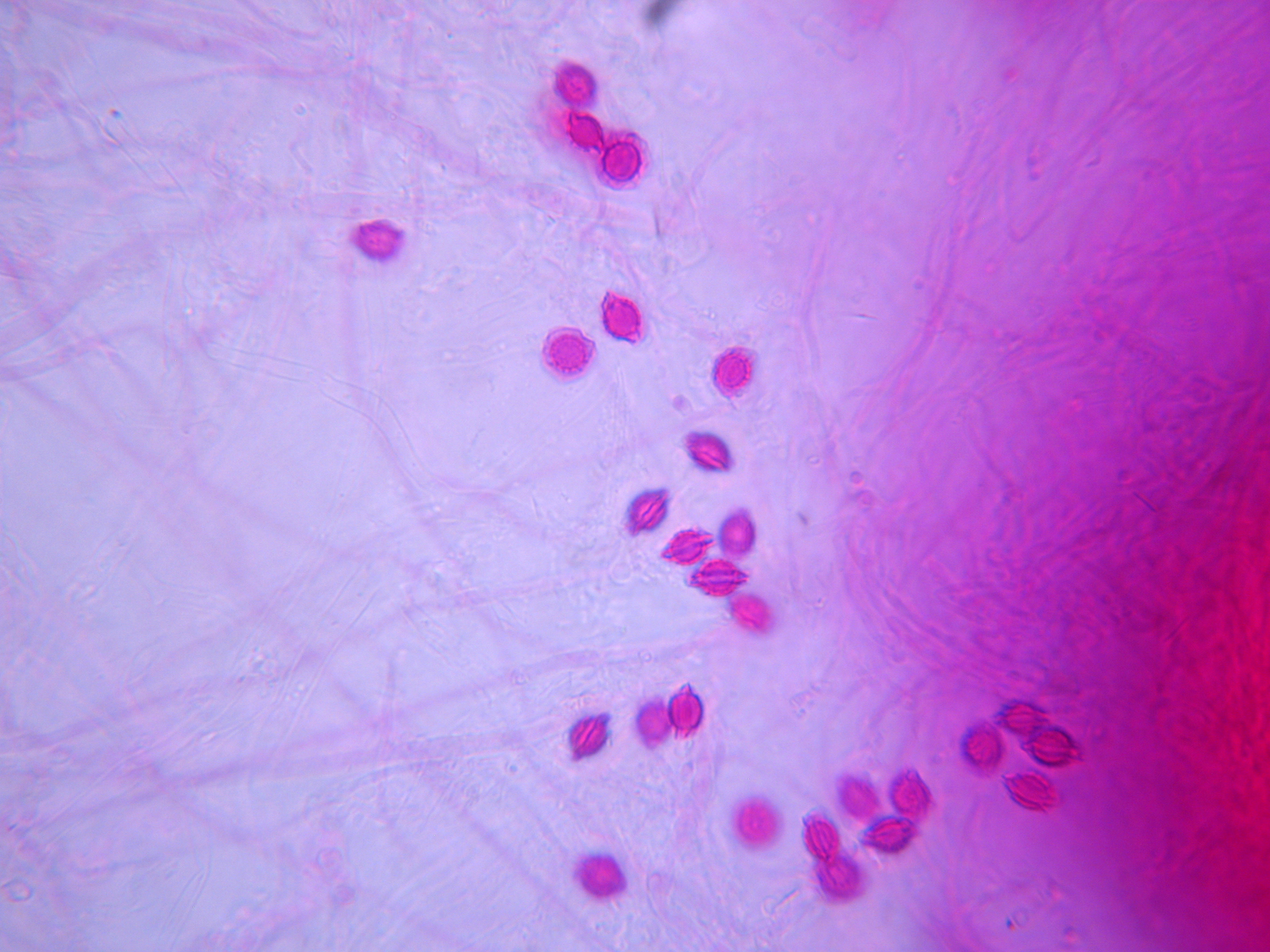
Conidios equinulados |
P. echinulatum |
|
| 17b |
Conidios lisos a finamente rugosos |
18 |
|
| 18a |
Conidióforos o estípites visiblemente verrugosos, conidios globosos de 4-5 μm de diámetro, colonias velutinosas, sin olor, el reverso típicamente verde oscuro |
P. roqueforti |
|
| 18b |
Conidióforos o estípites rugosos, conidios globosos a elipsoidales de 3-4.5 μm en diámetro, colonias fasciculadas, a menudo con olor pronunciado, el reverso no presenta una tonalidad verde oscuro |
19 |
|
| 19a |
Colonias con micelio amarillo y exudados marrón anaranjado |
P. hirsutum |
|
| 19b |
Colonias sin micelio amarillo y exudado marrón anaranjado |
20 |
|
| 20a |
Colonias en medios de cultivo Cz y MEA a 25° C, a los 7 días el crecimiento es menor a 10 mm de diámetro, de color verde amarillo y conidios pequeños de (2.5) 2.8-3.2 (-3.5) μm diámetro |
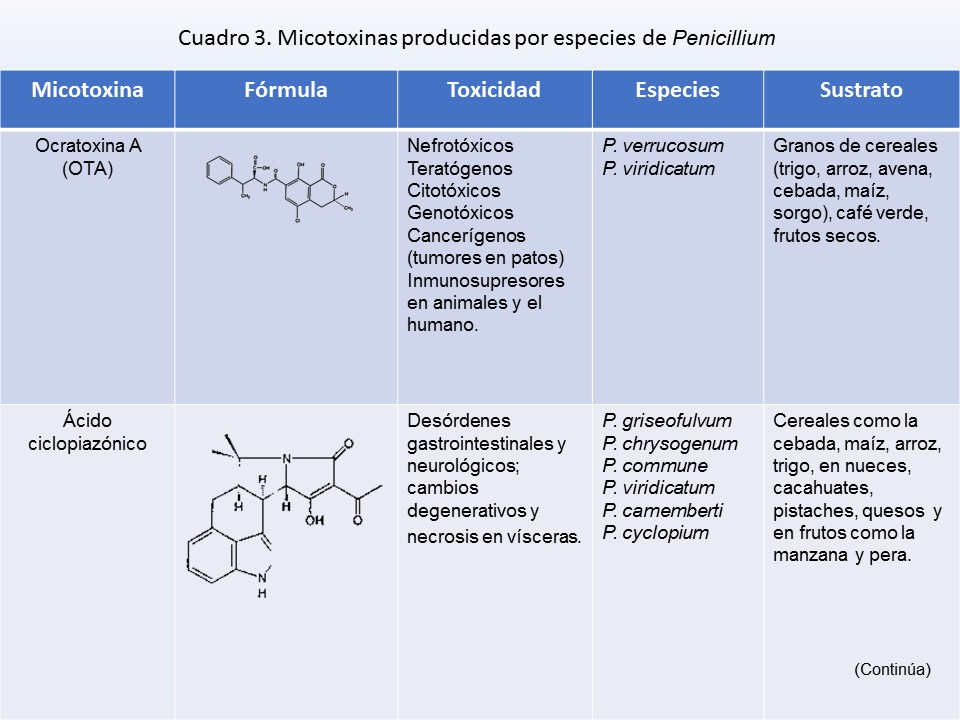
P. verrucosum* |
|
| 20b |
Colonias en Cz y MEA a 25°C a los 7 días, generalmente mayor a 10mm en diámetro |
21 |
|
| 21a |
Conidios relativamente pequeños (2.5-) 2.8-3.2 (-3.5) μm de diámetro, cuando es elipsoidal hasta 3.5(-4) μm de longitud; crecimiento escaso en CREA, producción de ácido |
22 |
|
| 21b |
Conidios relativamente grandes 3-4 (-5) μm de diámetro, cuando es elipsoidal hasta 4.5-6 μm de longitud; crecimiento abundante en CREA, generalmente presenta una reacción ácida o básica |
23 |
|
| 22a |
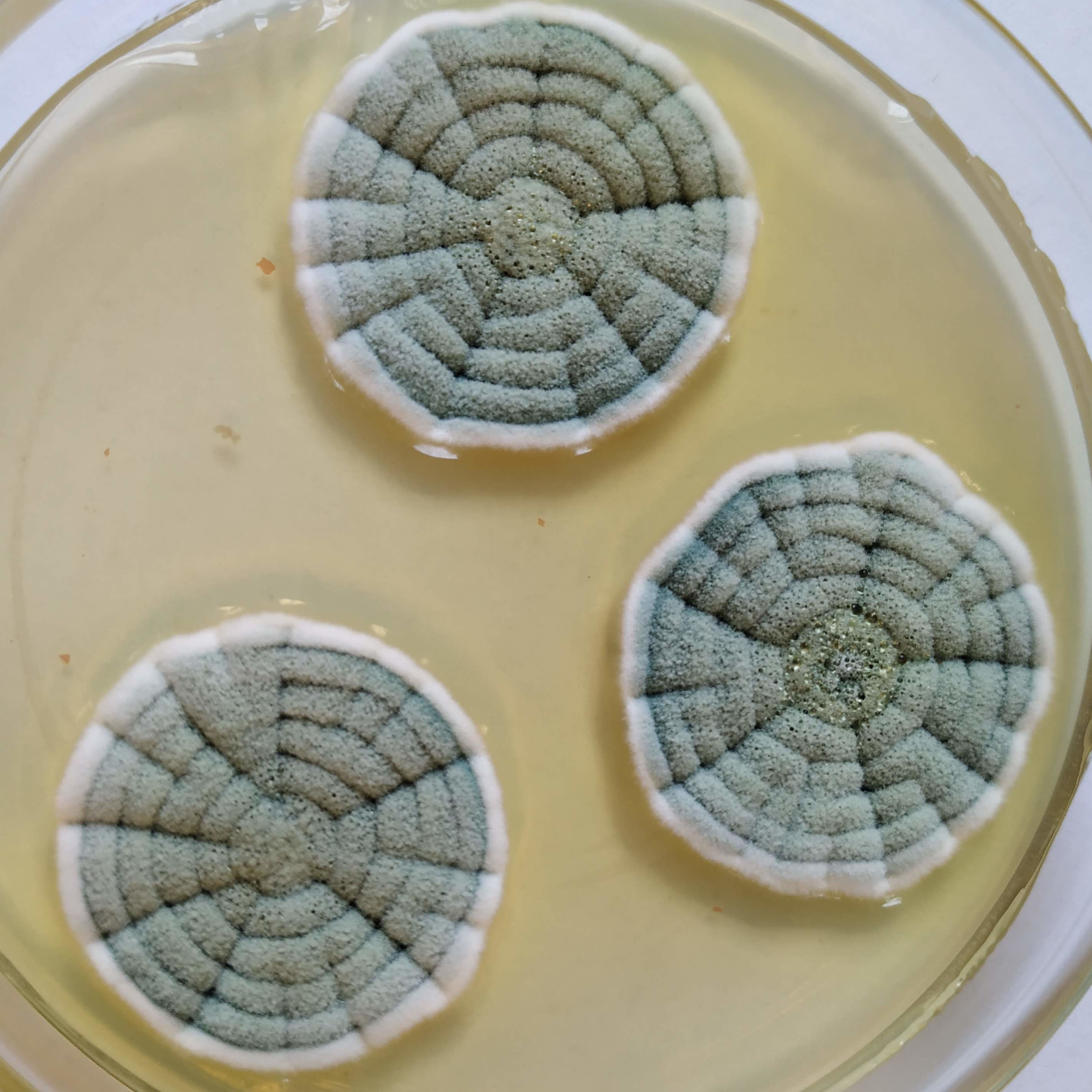
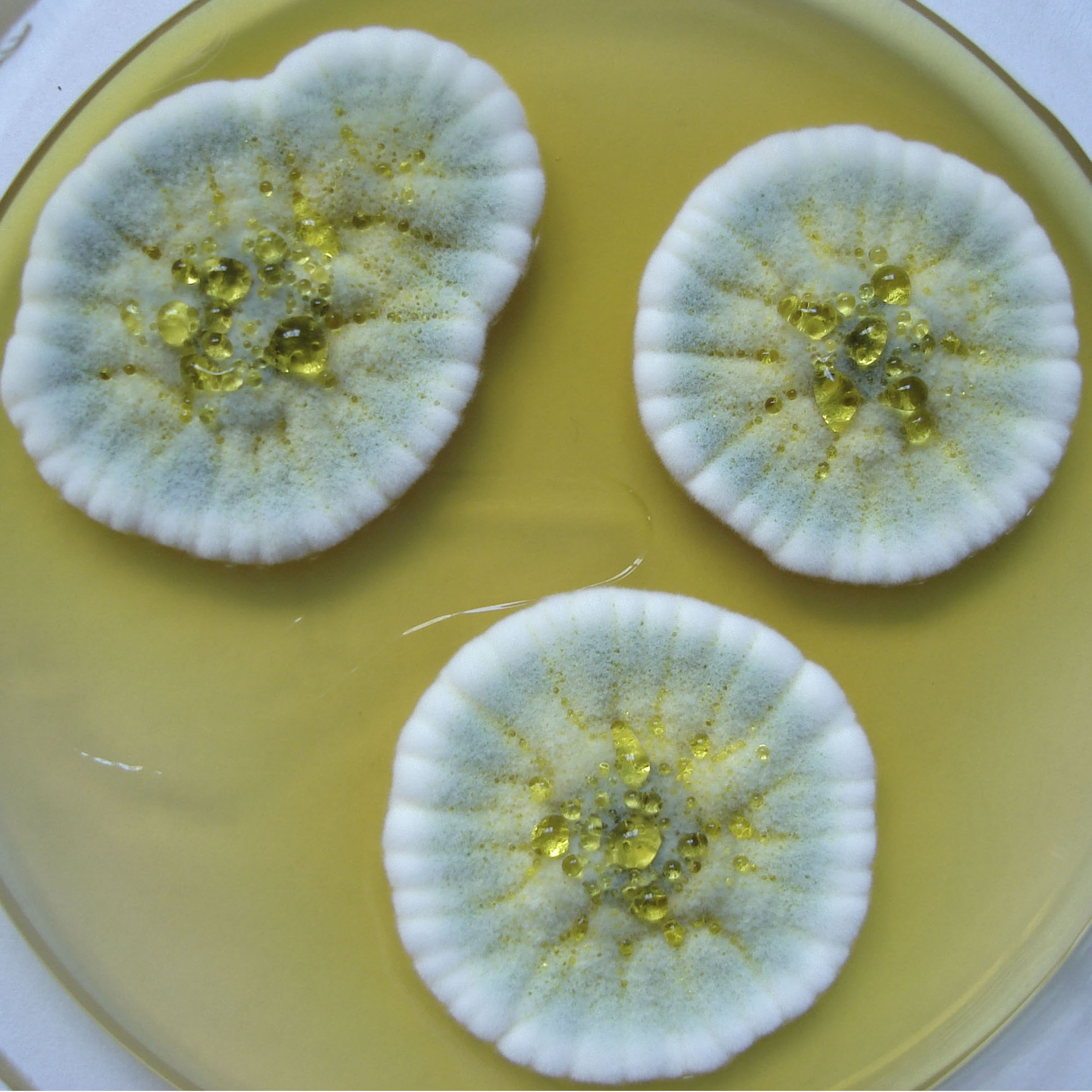
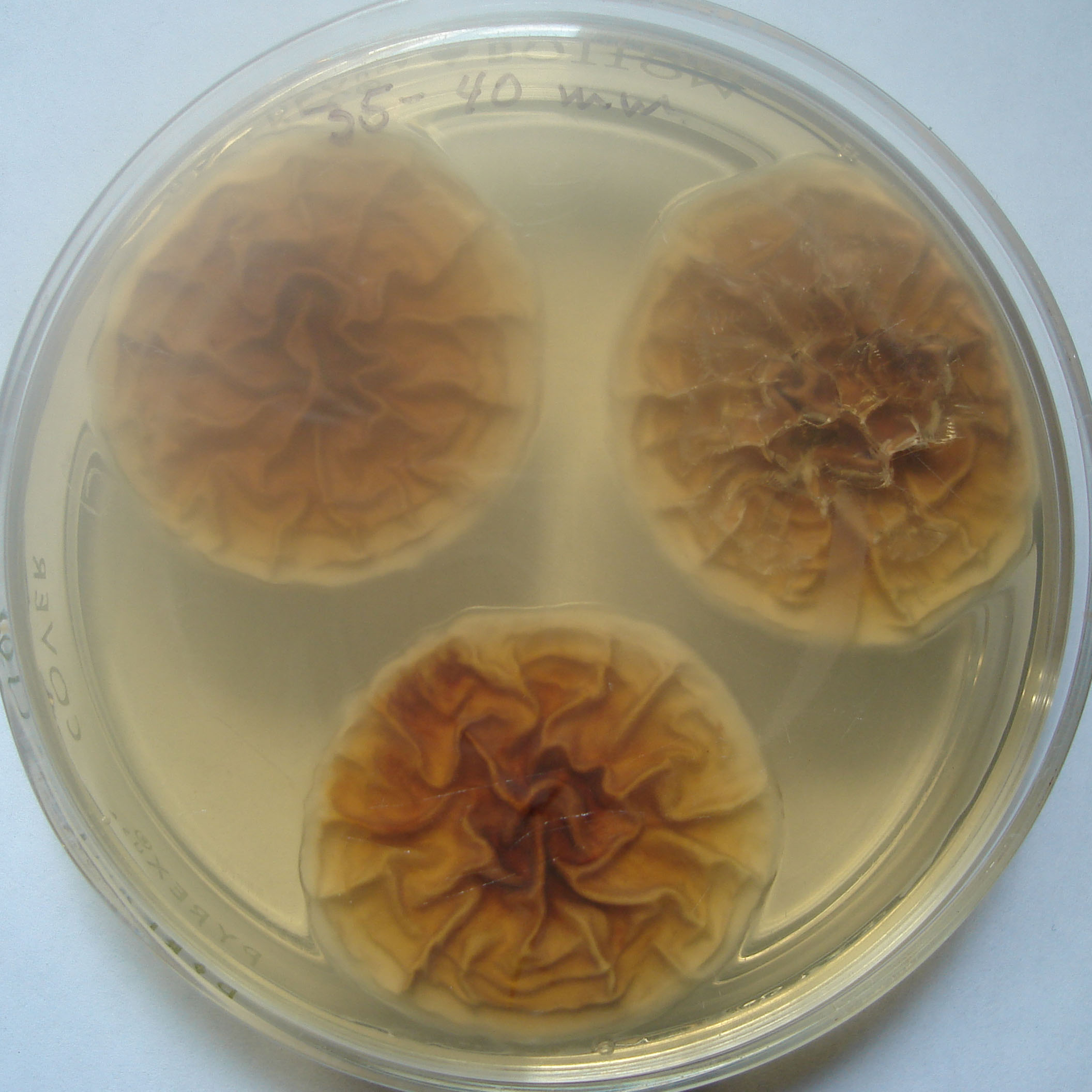
Colonias de color gris verde en MEA, conidios subglobosos a elipsoidales, crecimiento escaso en CREA |
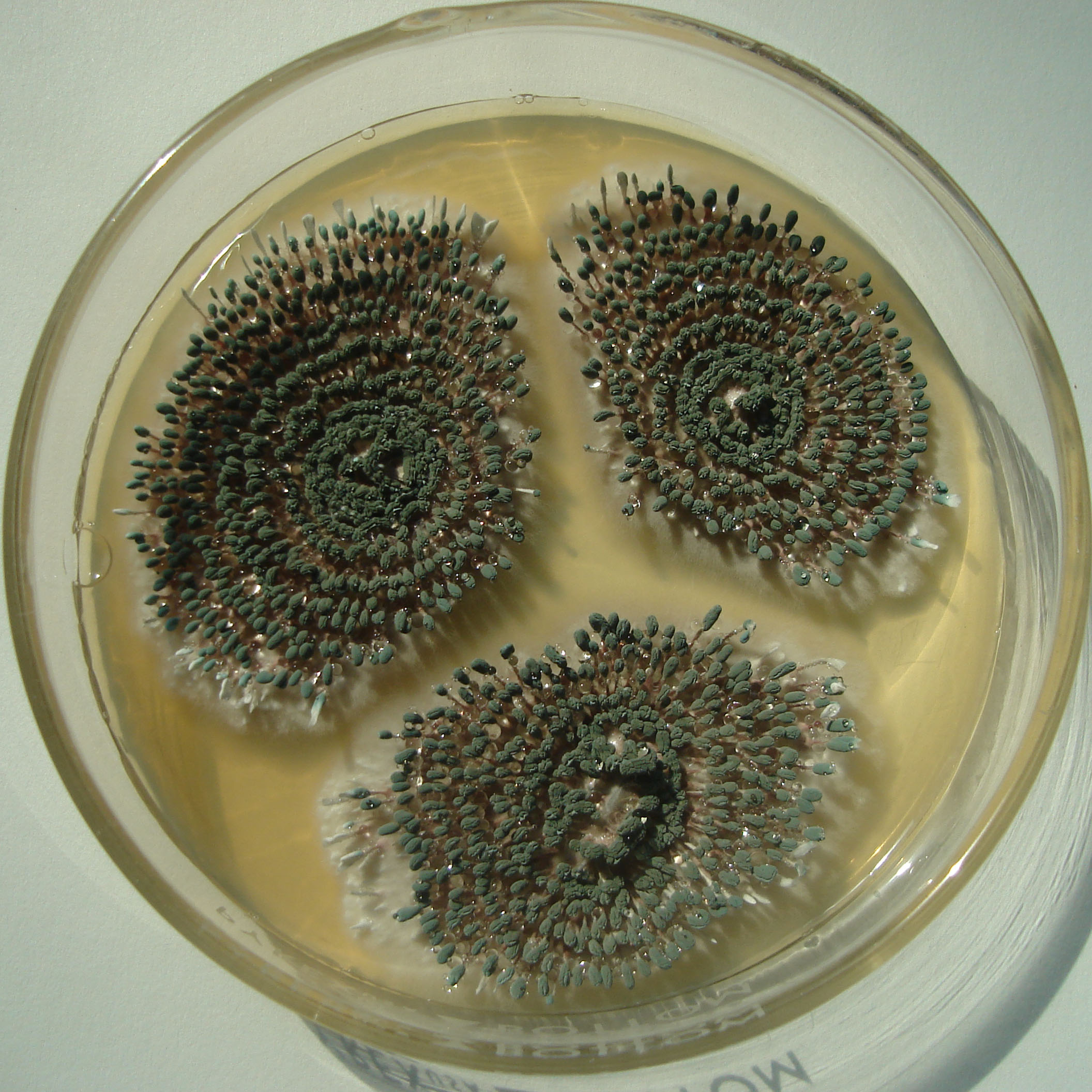
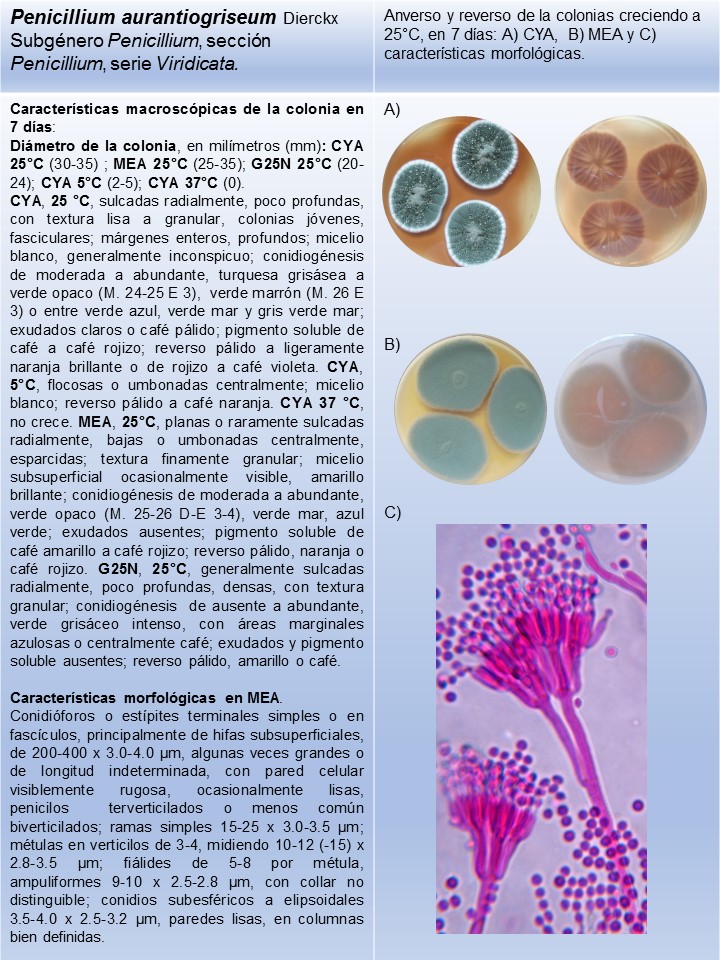
P. aurantiogriseum* |
Lámina 5
P. aurantiogriseum |
| 22b |
Colonias de color verde azul en MEA, velocidad de crecimiento rápido y esporulación abundante en todos los medios de cultivo, conidios subglobosos a elipsoidales |
P. polonicum |
|
| 23a |
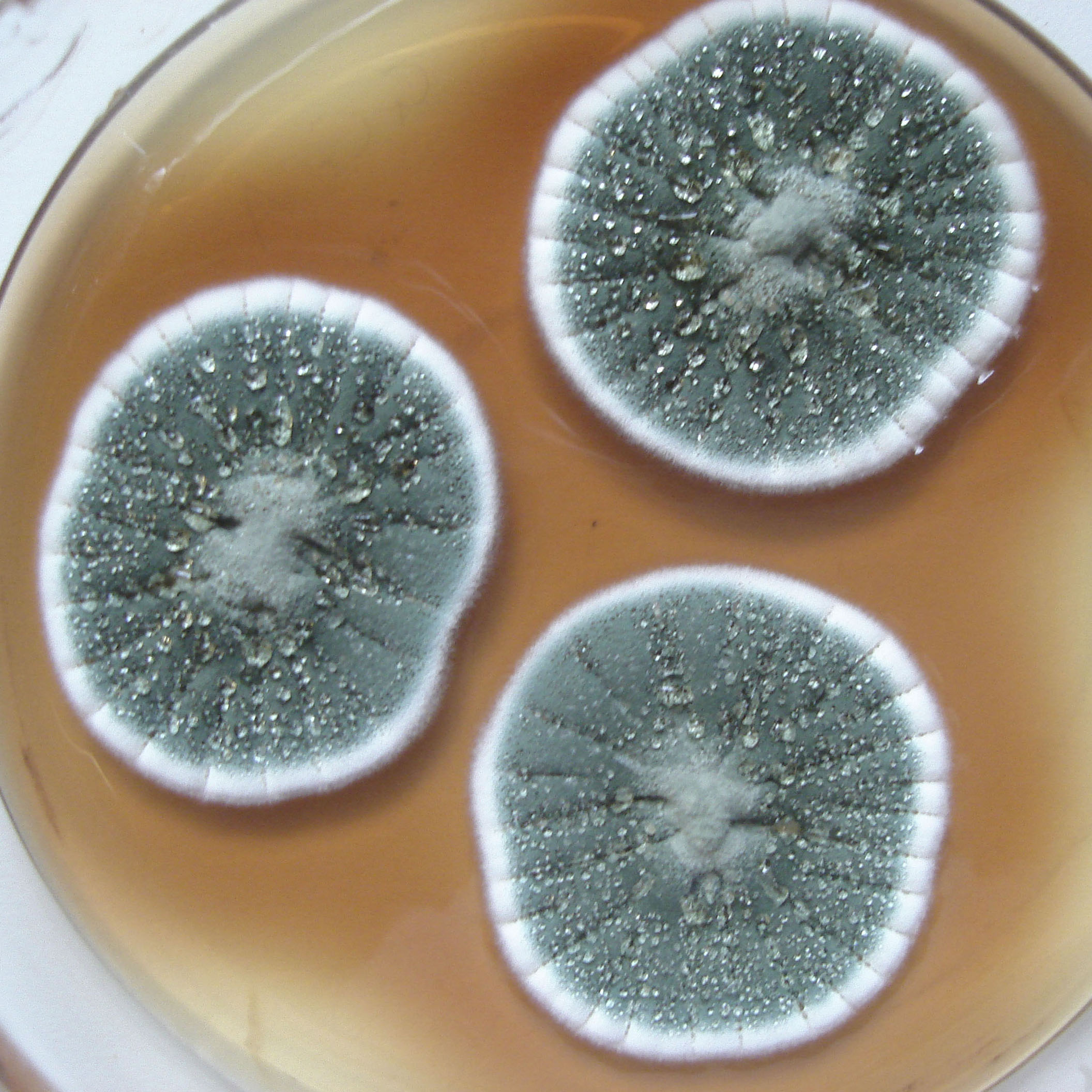
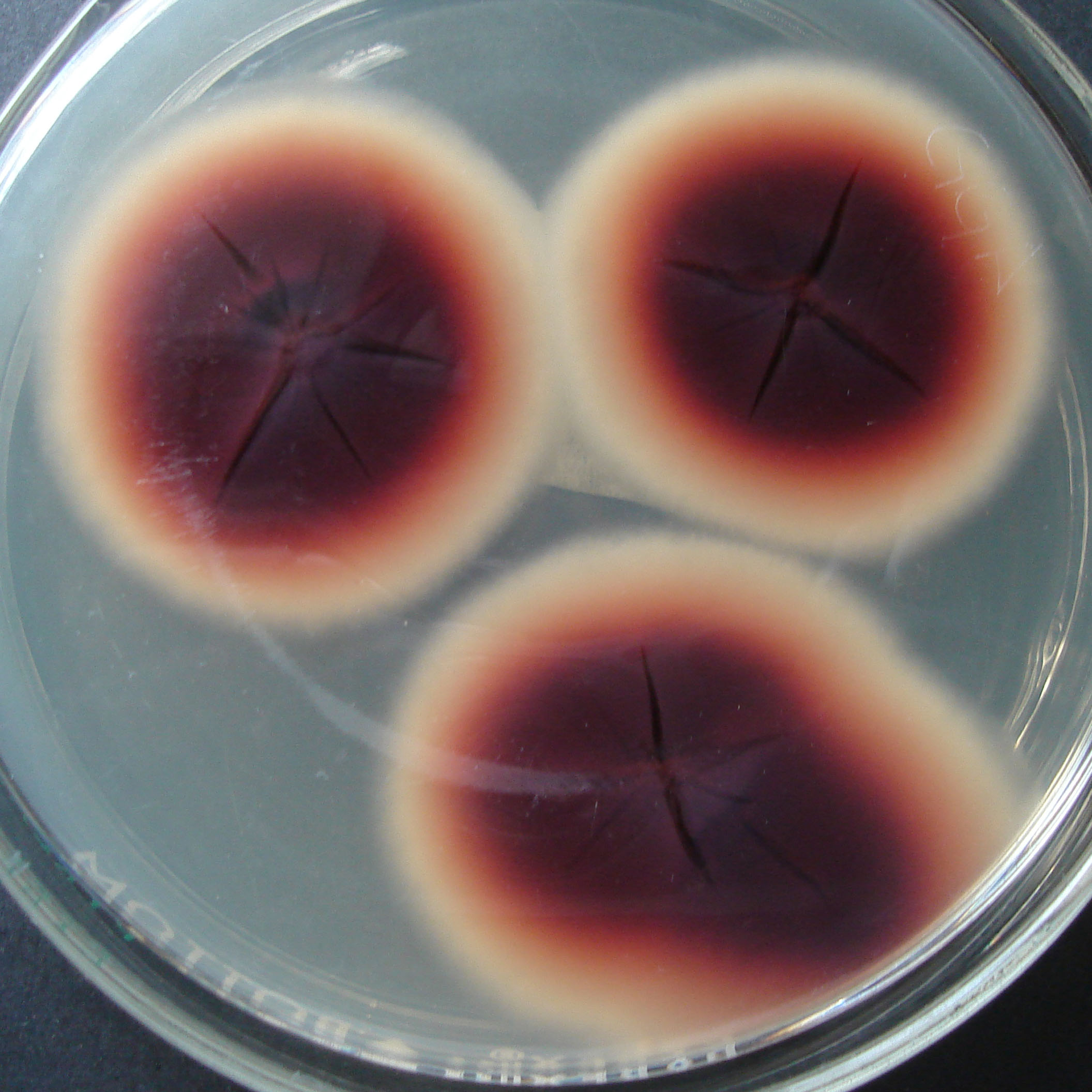
Áreas conidiales de color verde opaco a verde grisáceo, en aislados jóvenes las colonias presentan una textura costrosa después de 10 días |
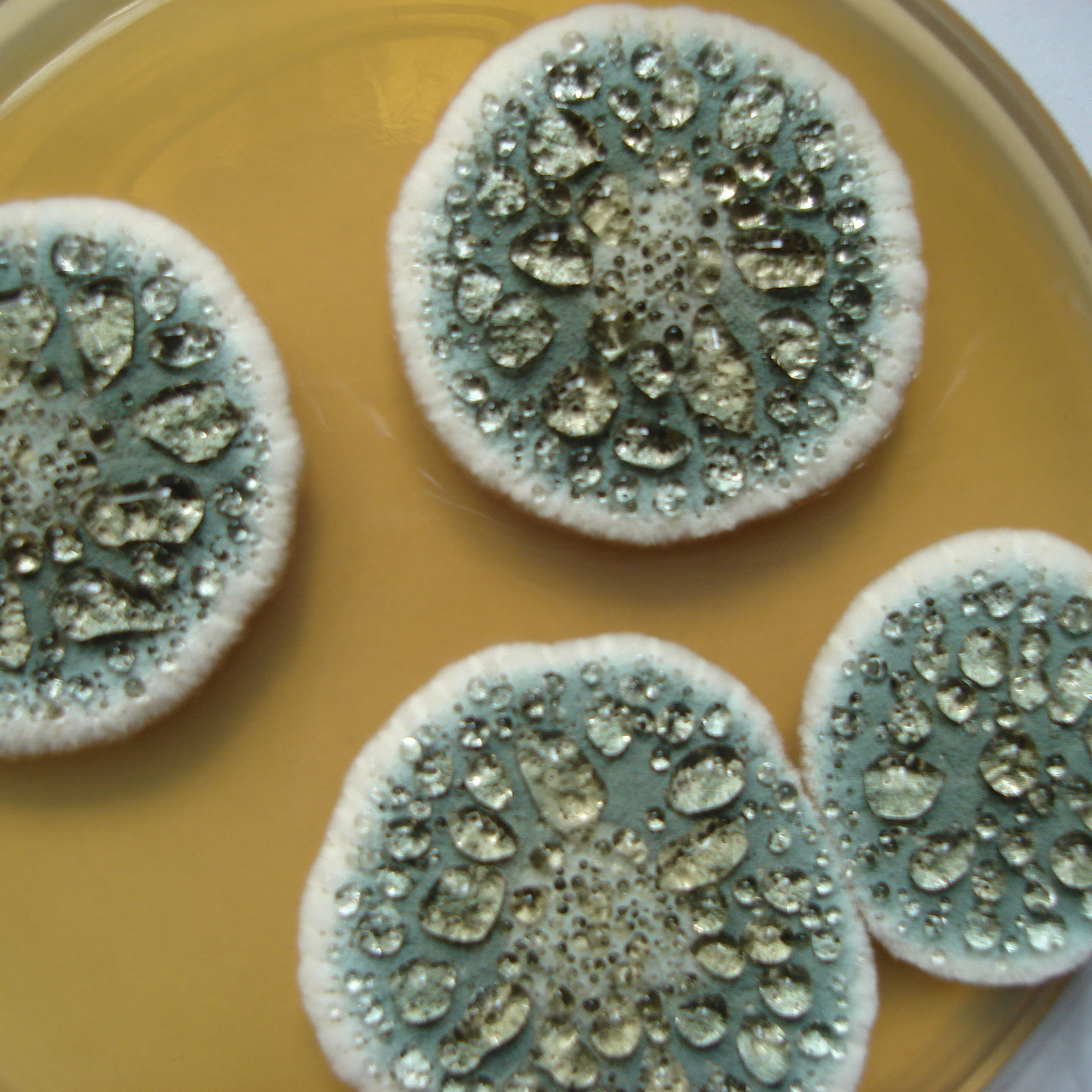
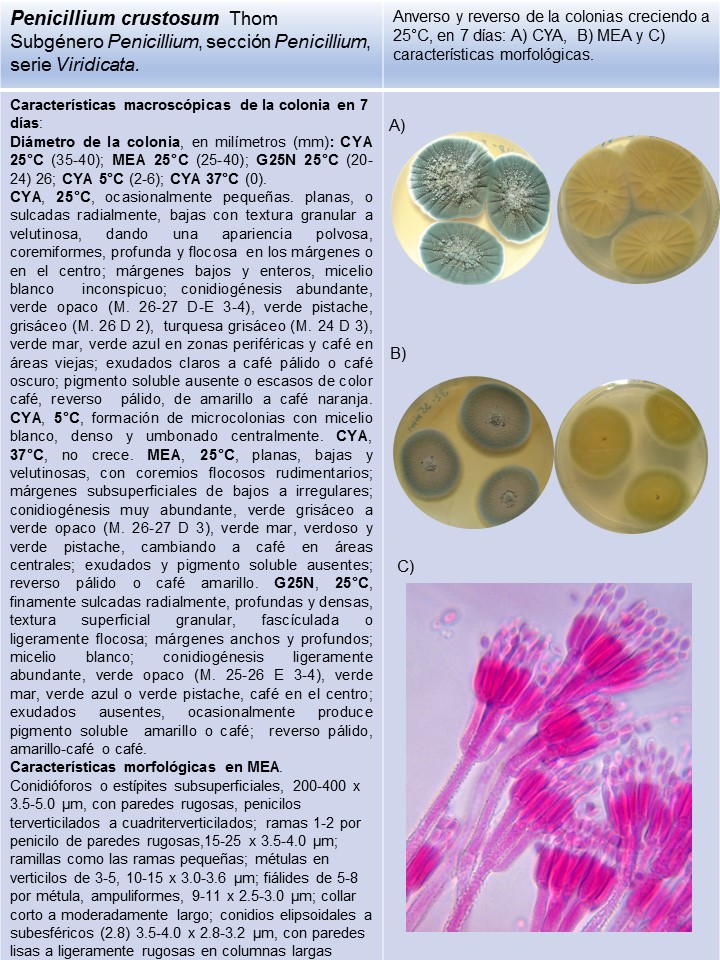
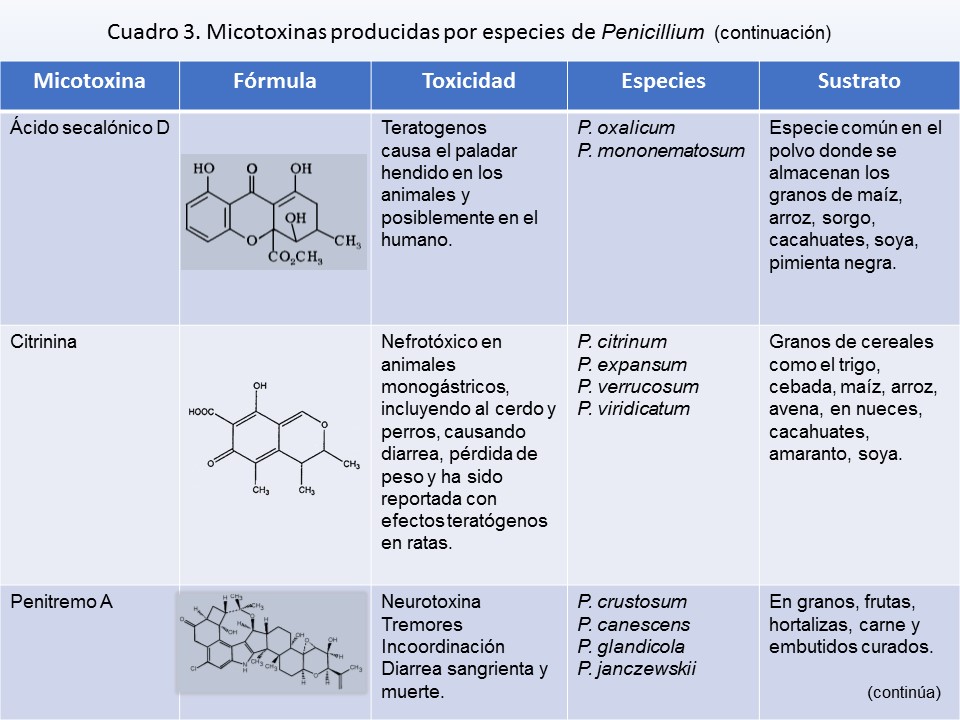
P. crustosum* |
Lámina 6
P. crustosum |
| 23b |
Áreas conidiales en varios tonos azul verdosos o verdes, las colonias no presentan una textura costrosa |
24 |
|
| 24a |
Áreas conidiales en aislados jóvenes de color azul-verde oscuro sobre verde oscuro; el reverso de la colonia en Cz es incoloro, amarillento o pardusco; conidios subglobosos |
P. solitum |
|
| 24b |
Áreas conidiales en aislados jóvenes de color azul pálido verdoso, verde-amarillo o verde-grisáceo; el reverso de la colonia en Cz es incoloro o amarillento, conidios subglobosos a elipsoidales |
P. commune* |
|