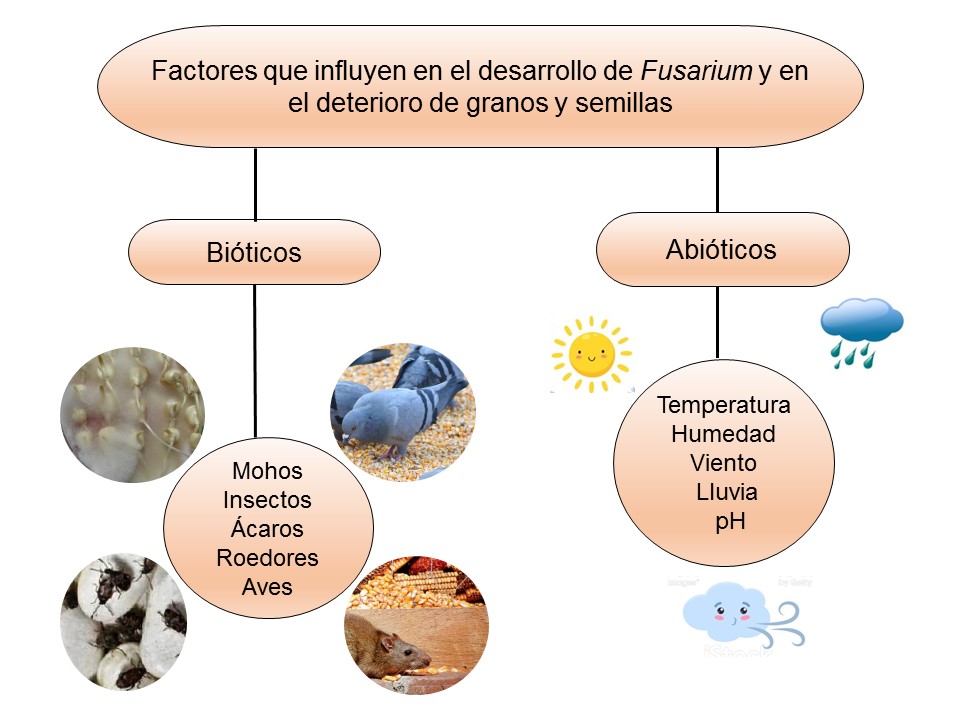
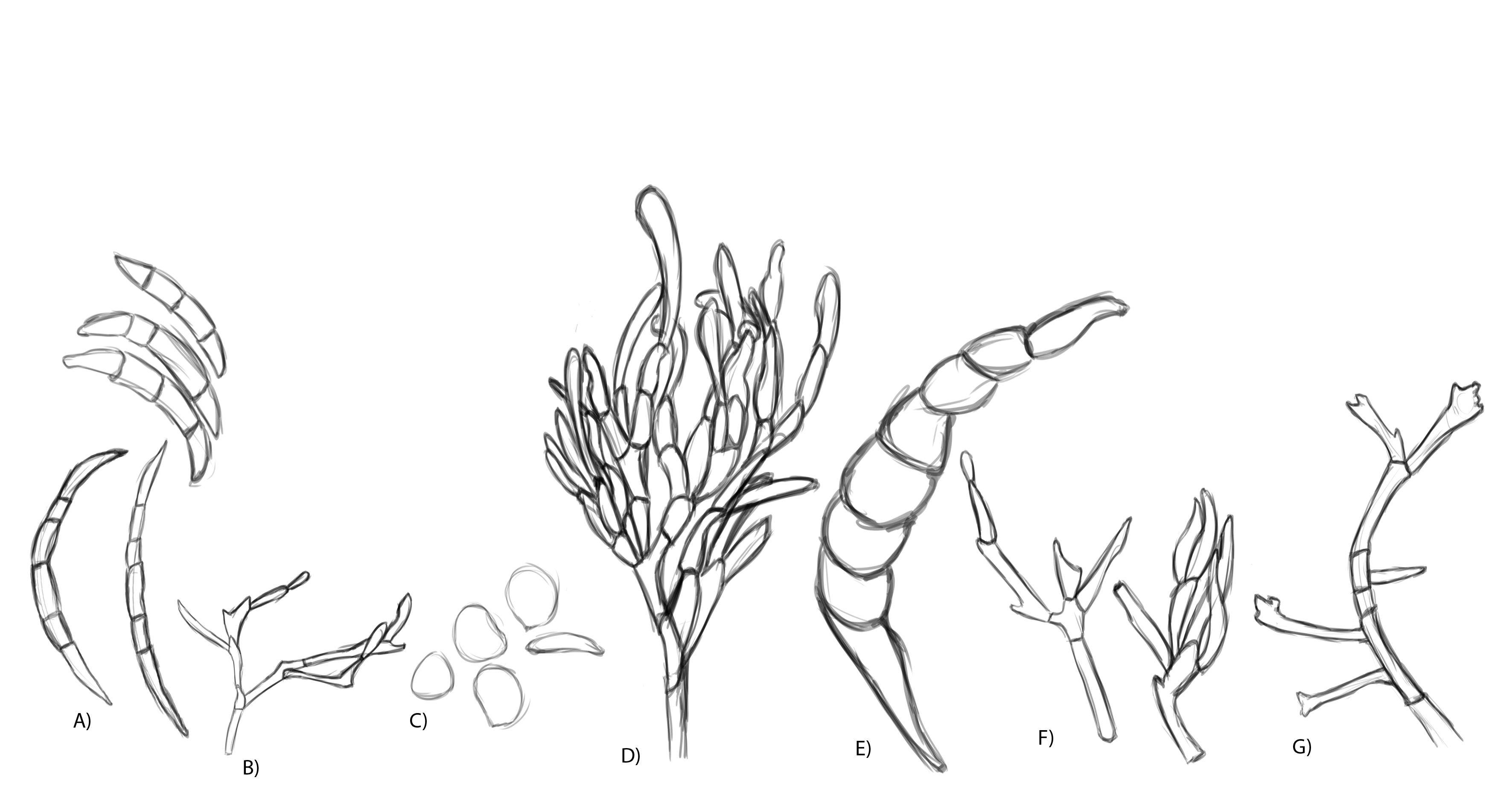
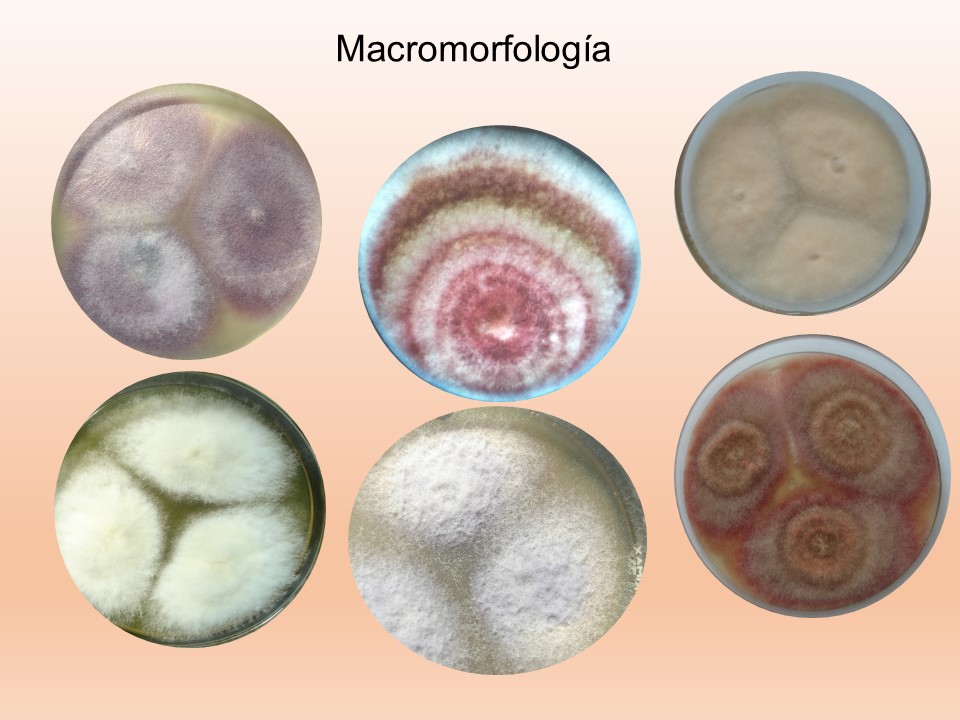
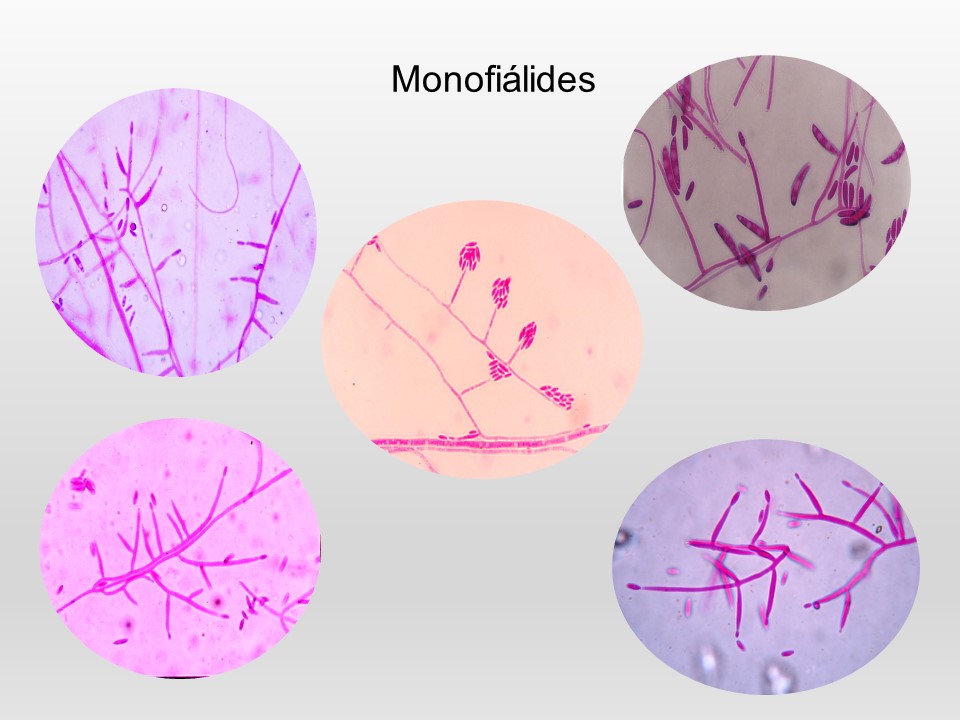
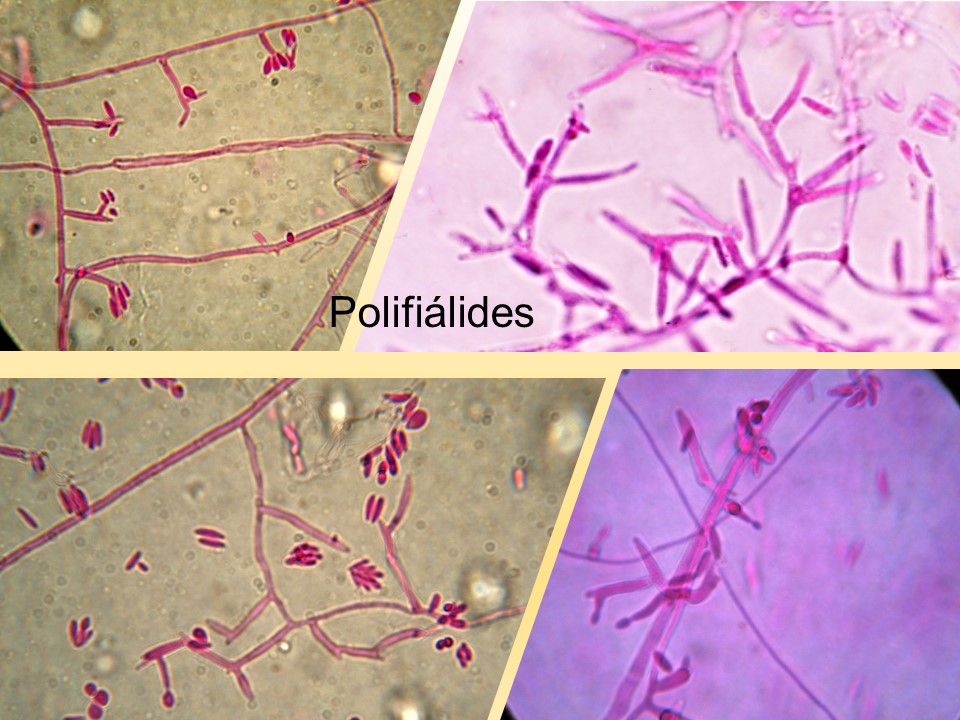
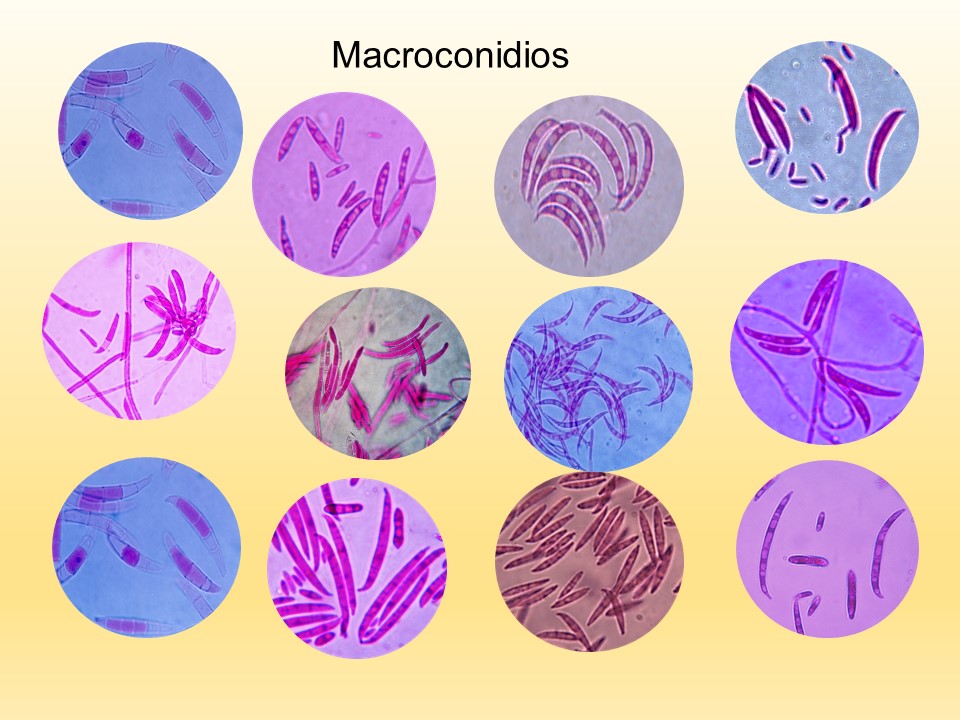
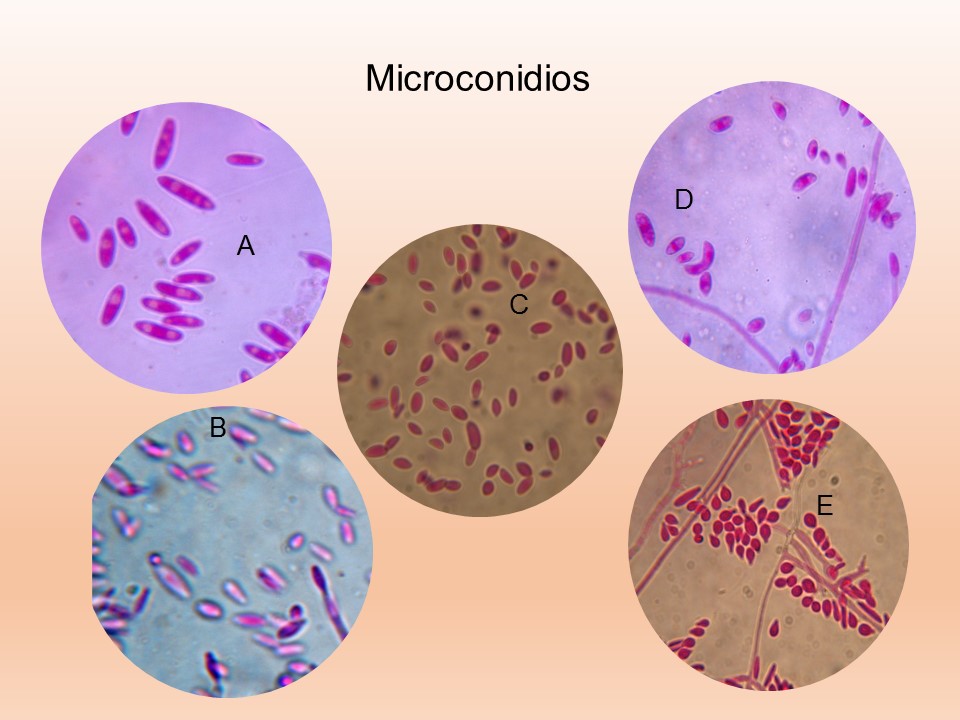
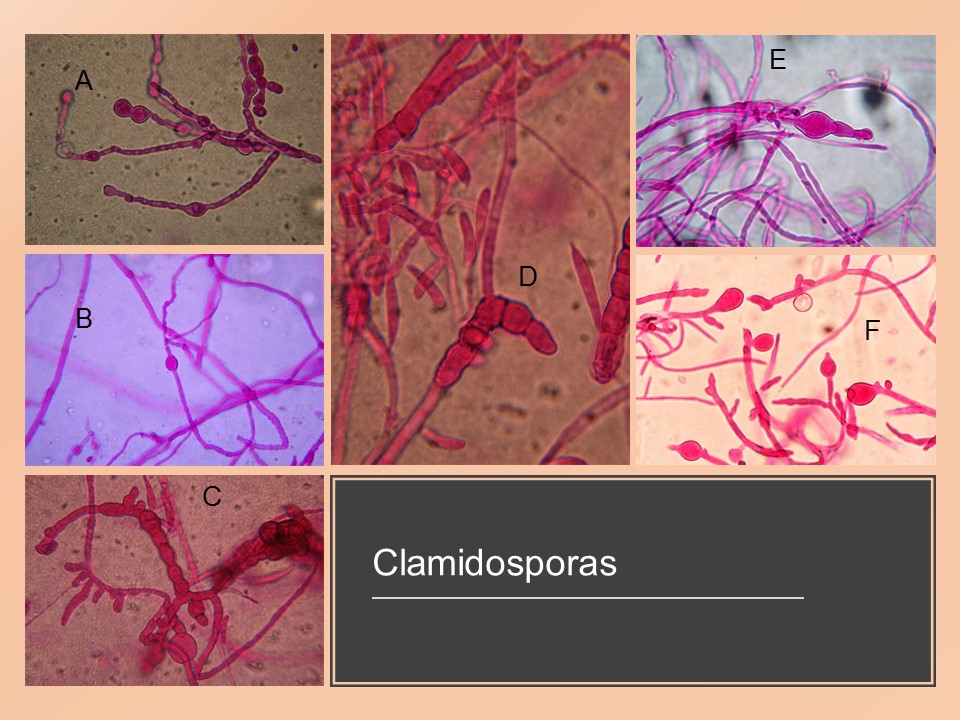
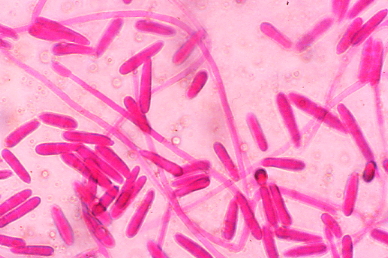
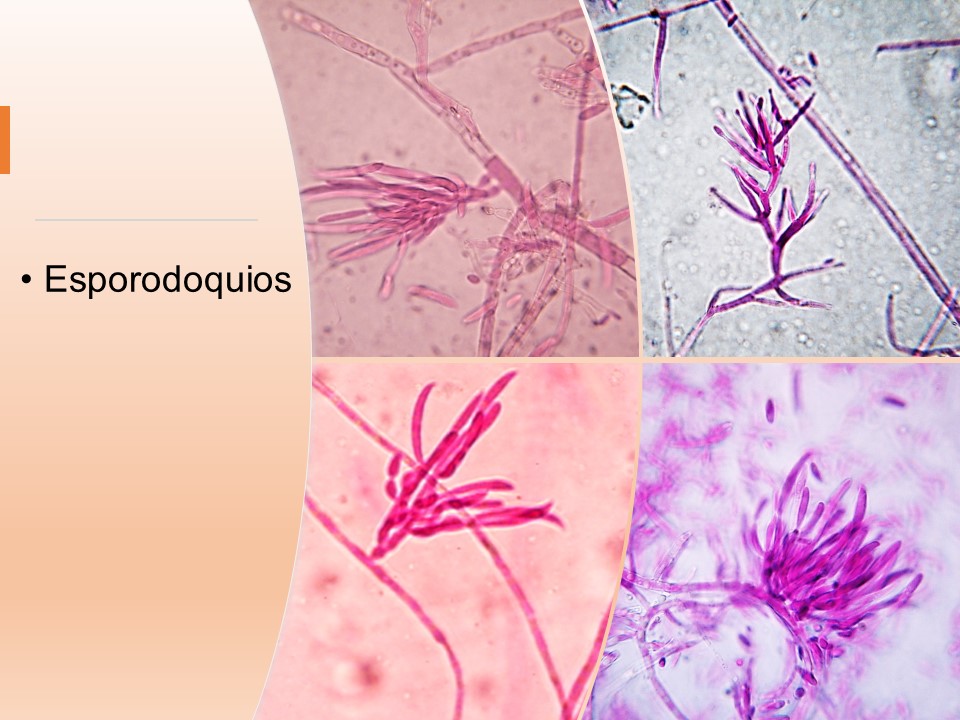
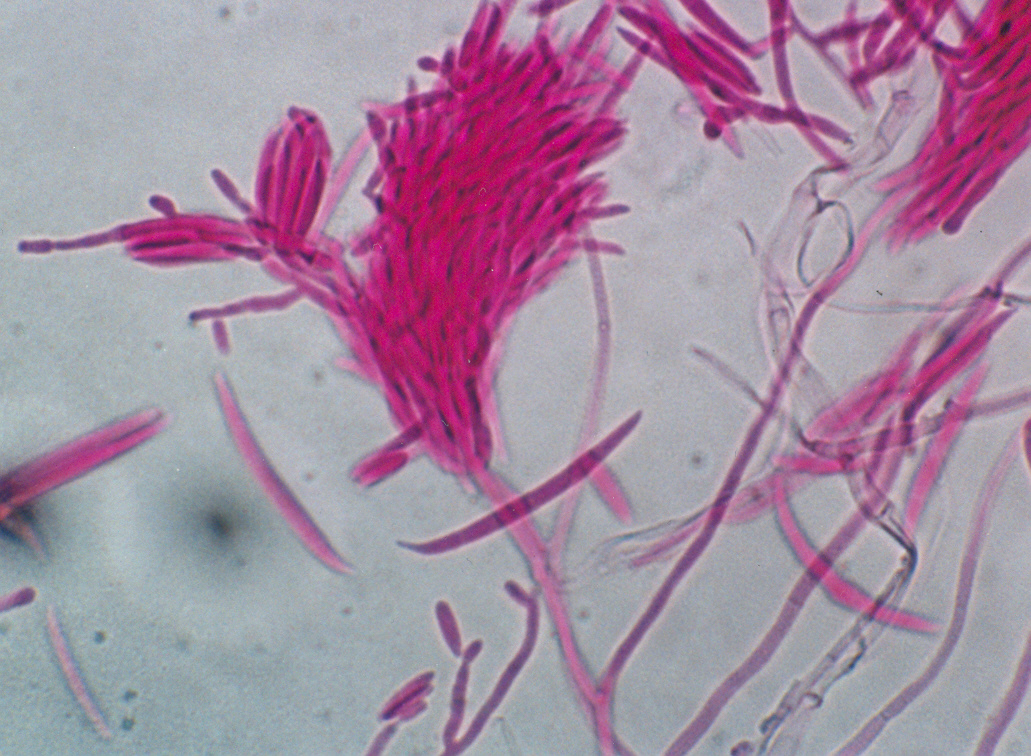
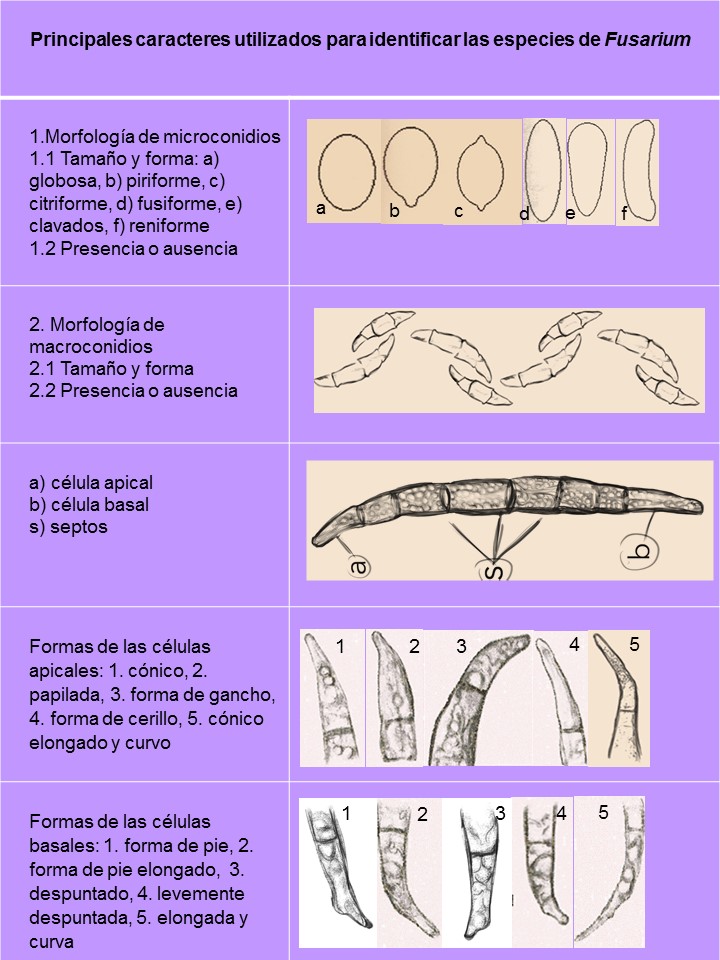
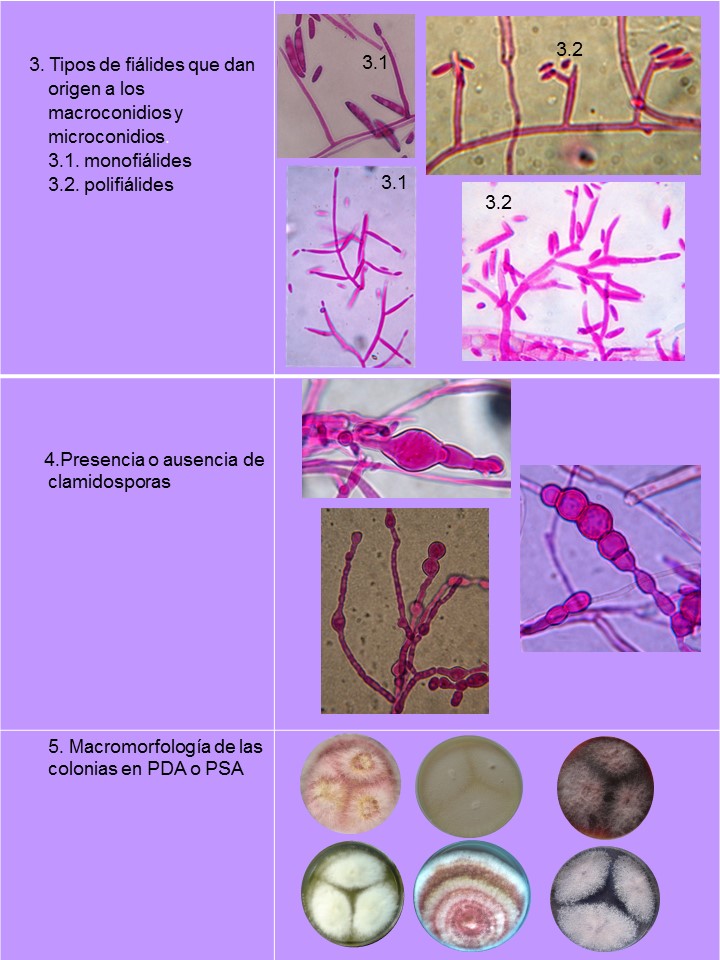
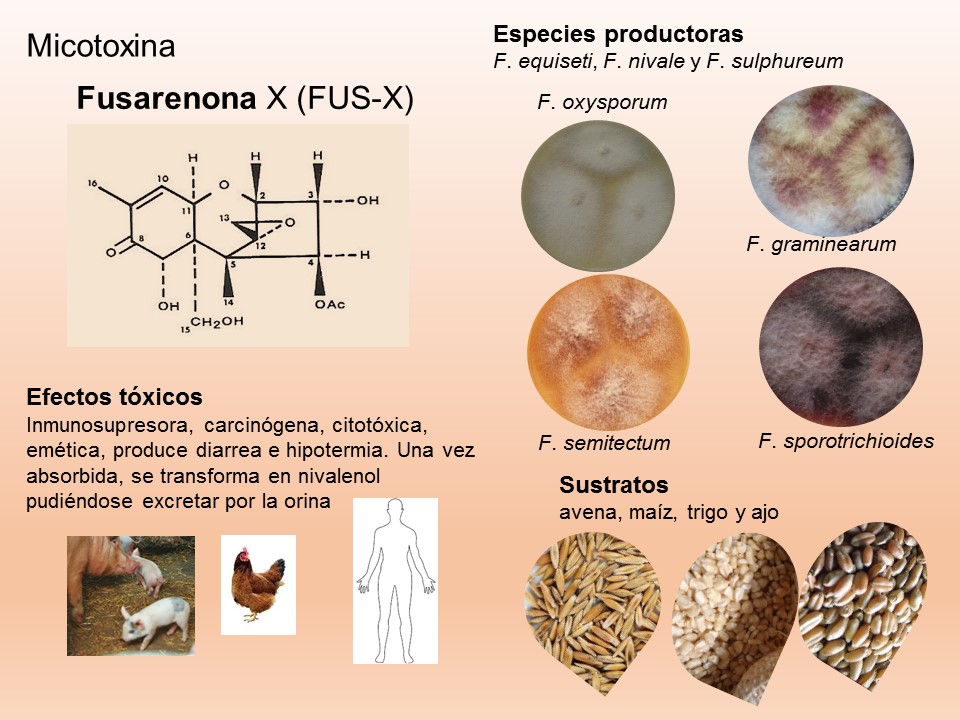
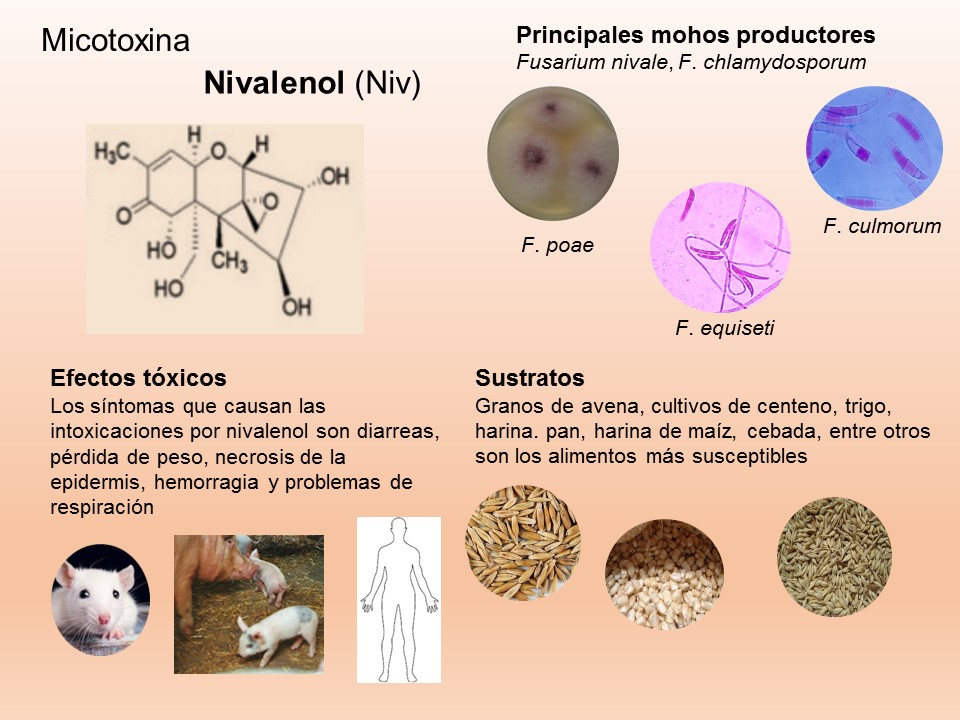
El género Fusarium pertenece a los mohos filamentosos que están ampliamente distribuidos a nivel mundial y son comunes en los suelos, tiene muchas especies que pueden causar enfermedades en plantas, animales y humanos. Se relacionan principalmente con cultivos de cereales. Por lo que, algunas de sus especies son consideradas fitopatógenas e infectan a una amplia gama de cultivos, incluyendo maíz, trigo, avena, cebada, frijol, soya, calabaza, melón y sandía, así como, algunas semillas de oleaginosas, girasol y linaza, entre otros. Causando la muerte de las plántulas, el aborto de semillas, la pudrición del grano y las plántulas, tizón, clorosis, marchitamiento vascular, muerte y reducción del crecimiento en una gran variedad de plantas hospederas.

Figura 1. Mazorcas de maíz azul y blanco infectadas con especies del género Fusarium.
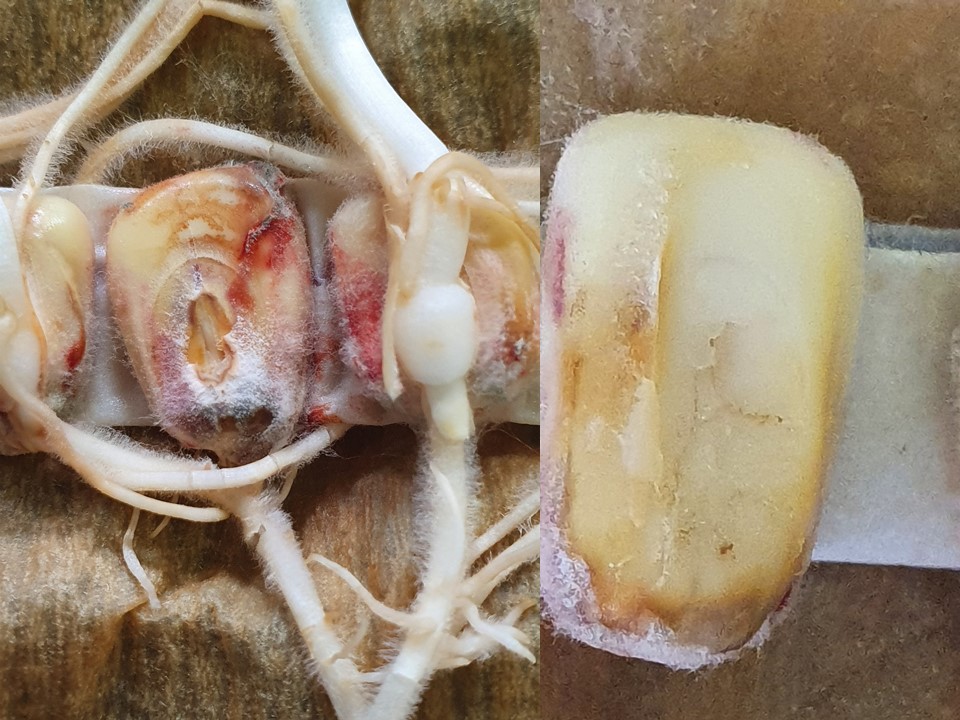
Figura 2. Granos de maíz contaminados con especies de Fusarium.
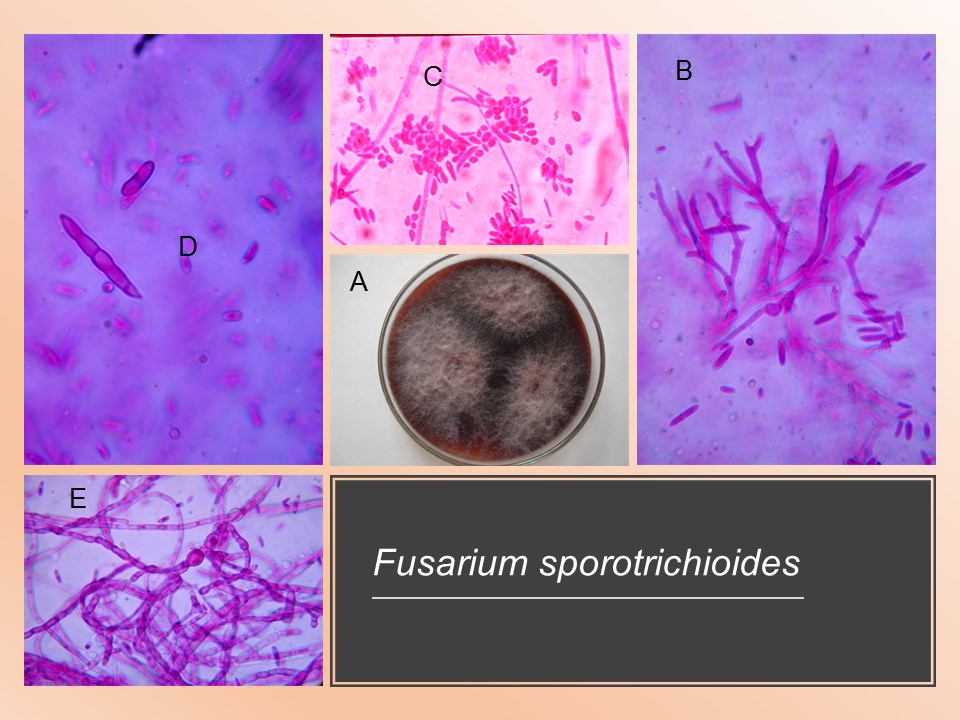
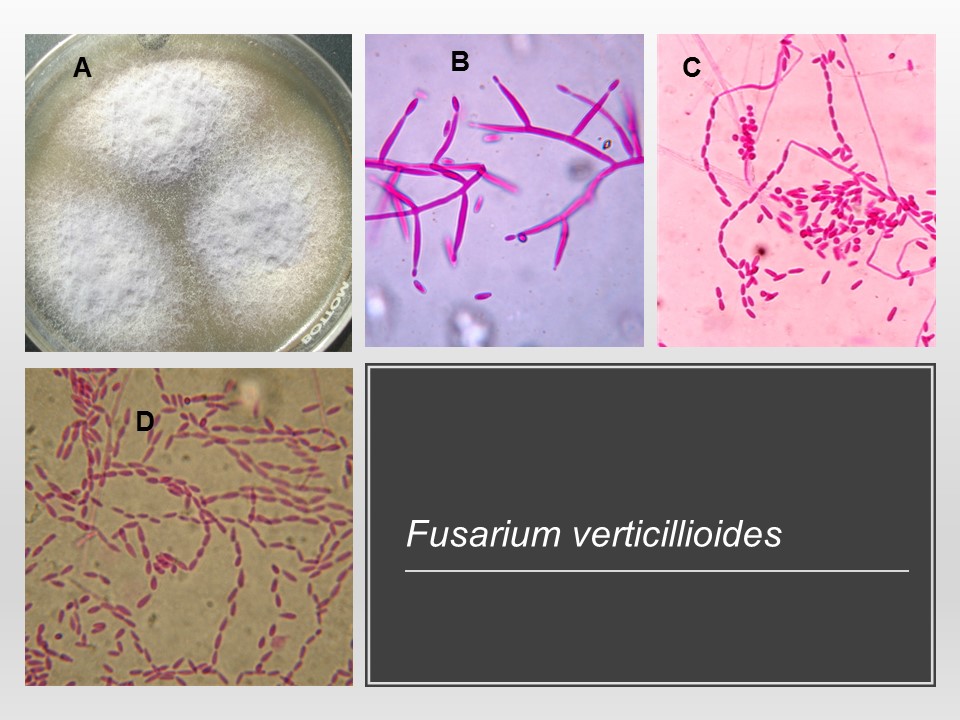
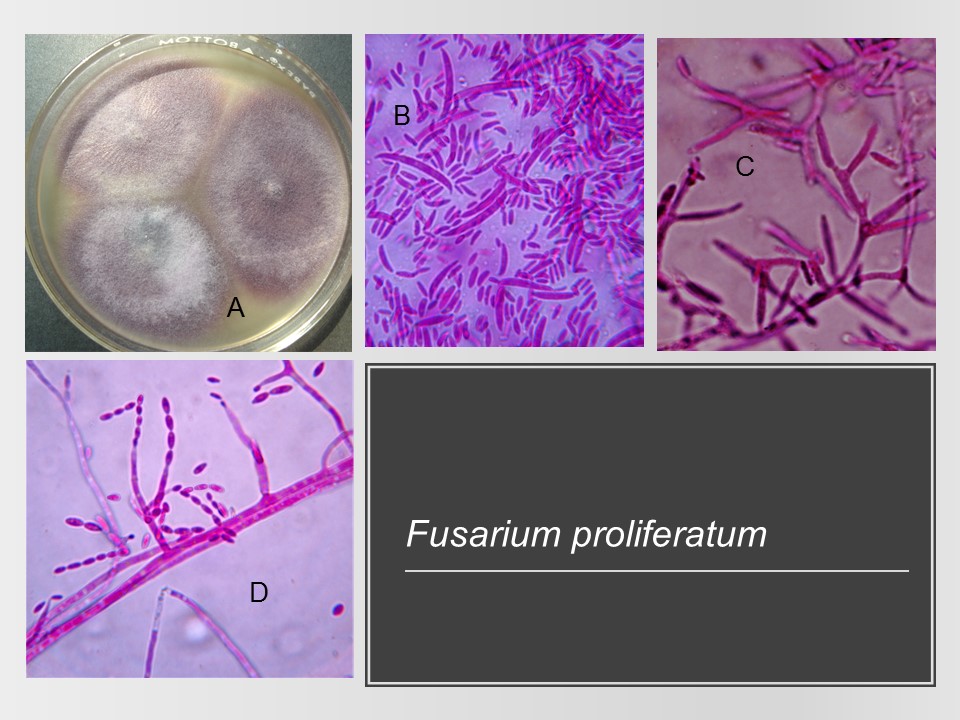
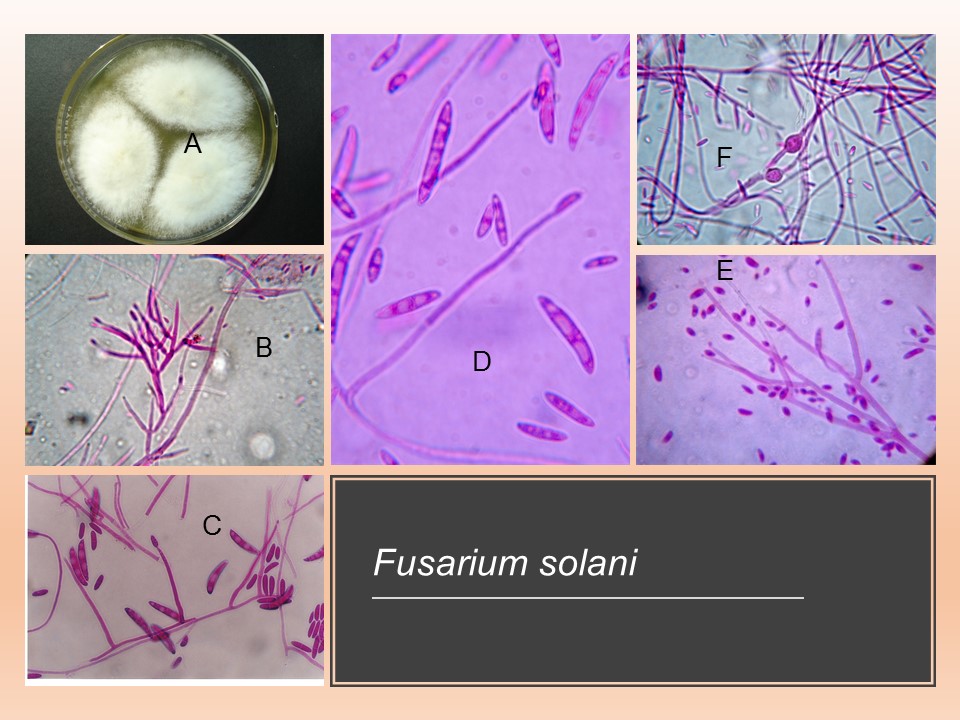
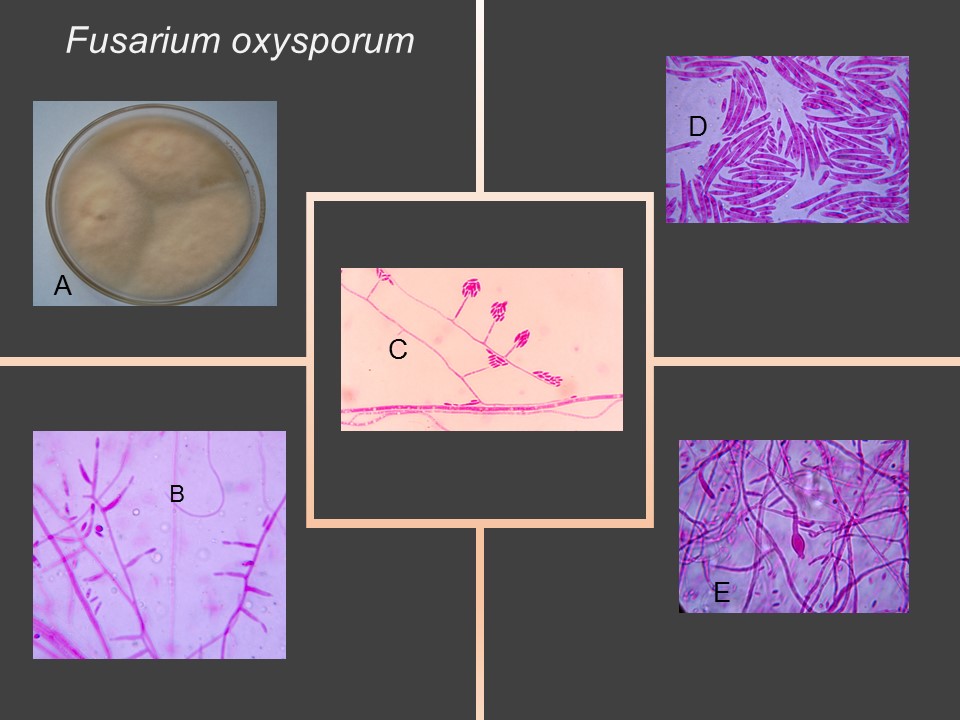
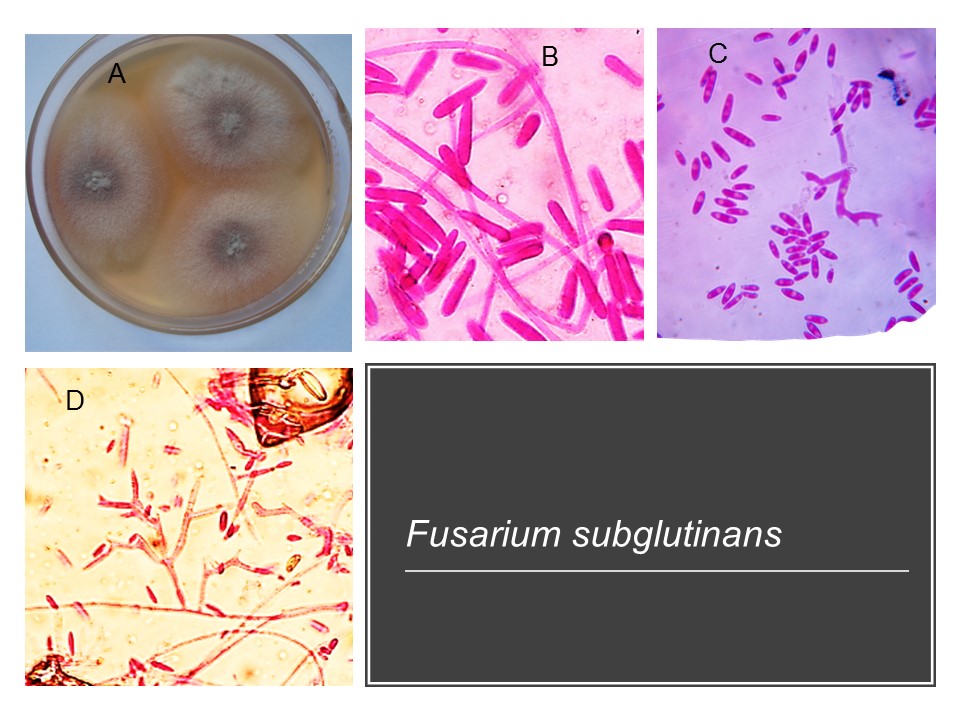
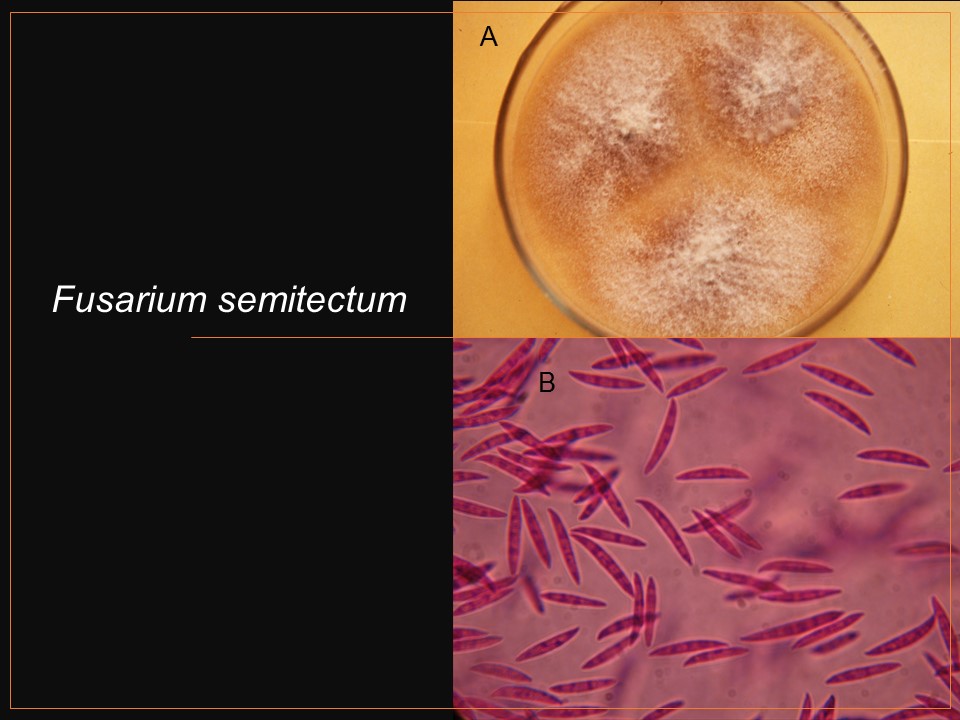
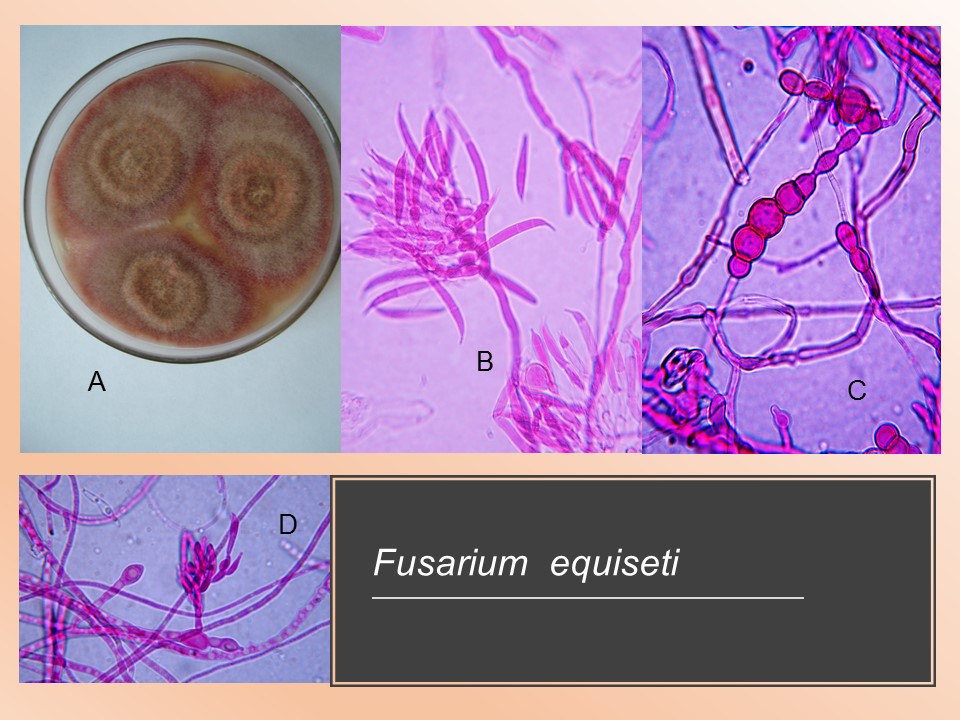
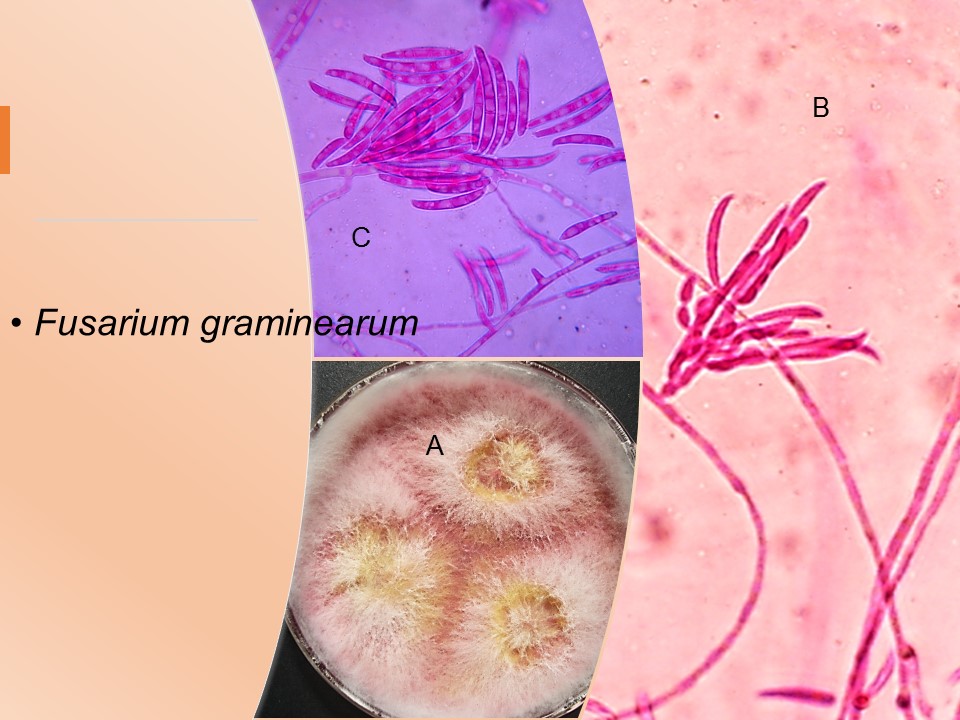
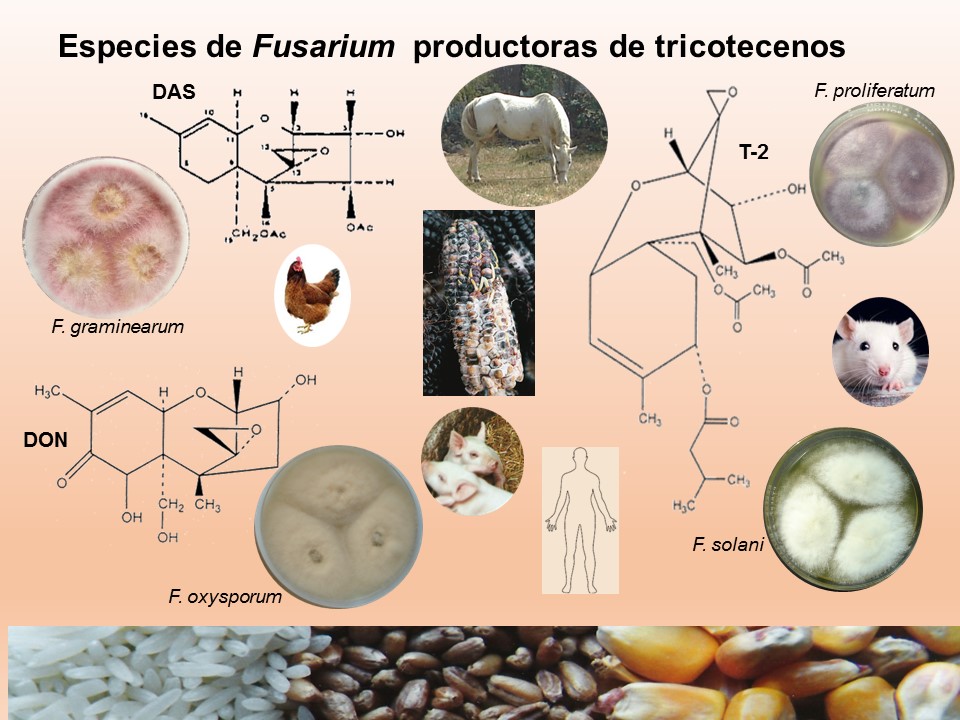
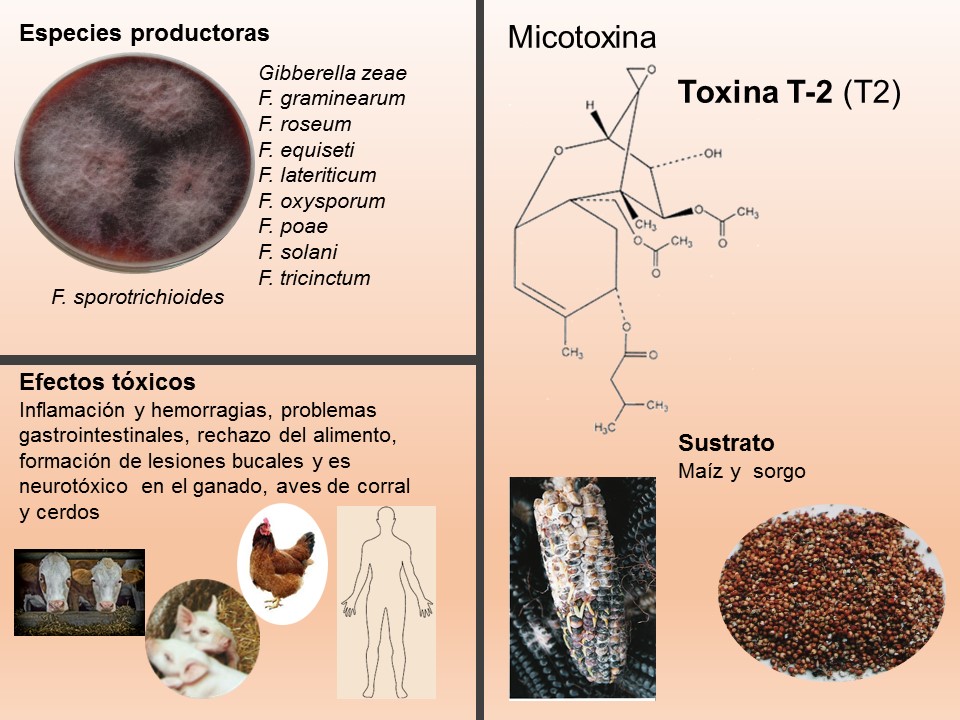
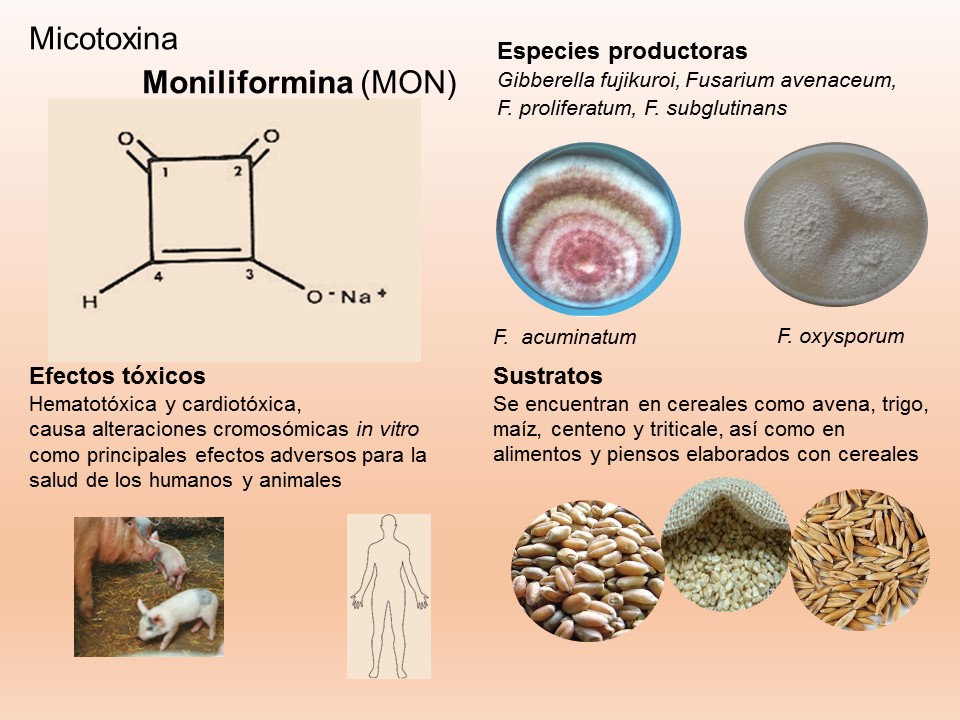
Para el cultivo de maíz, las especies de Fusarium más importantes son F. verticillioides sin. F. moniliforme, F. proliferatum, F. subglutinans y F. graminearum, F. sporotrichioides, F. oxysporum, F. solani y F. equiseti, asociadas con la pudrición del tallo y mazorca. De todos ellos F. verticillioides y F. graminearum son los más frecuentes.

Figura 3. Mazorcas de maíz azul contaminadas con especies del género Fusarium, causando germinación prematura.
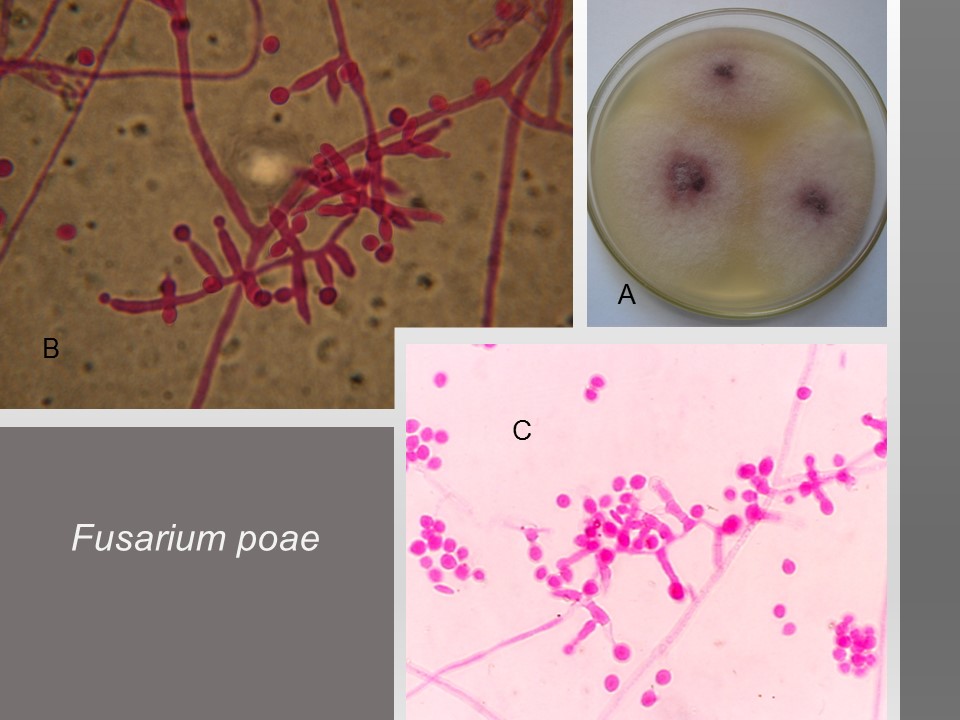
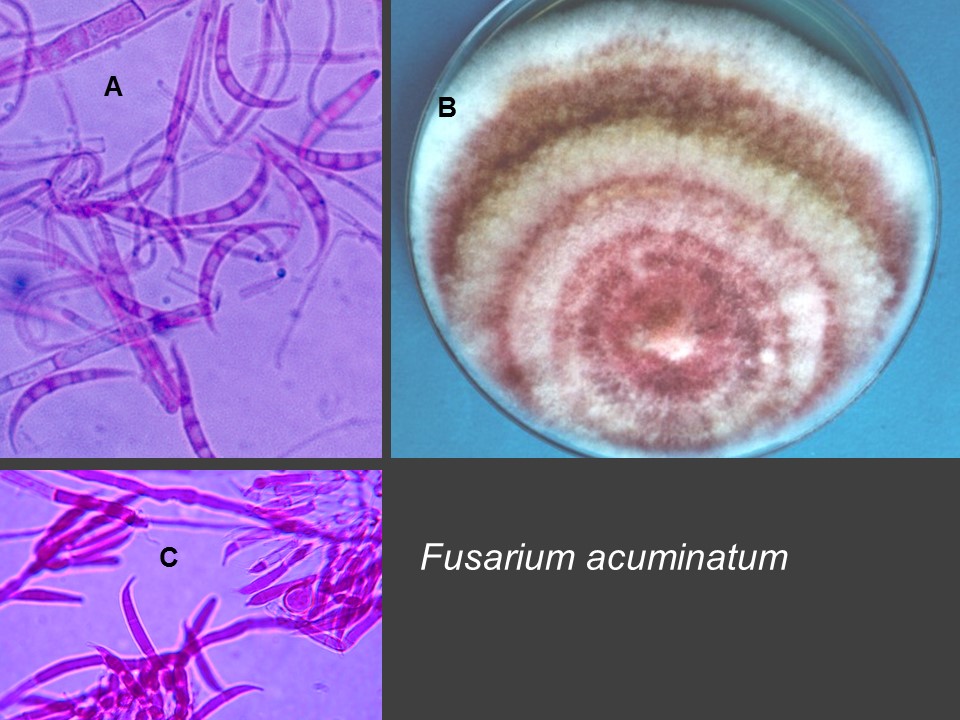
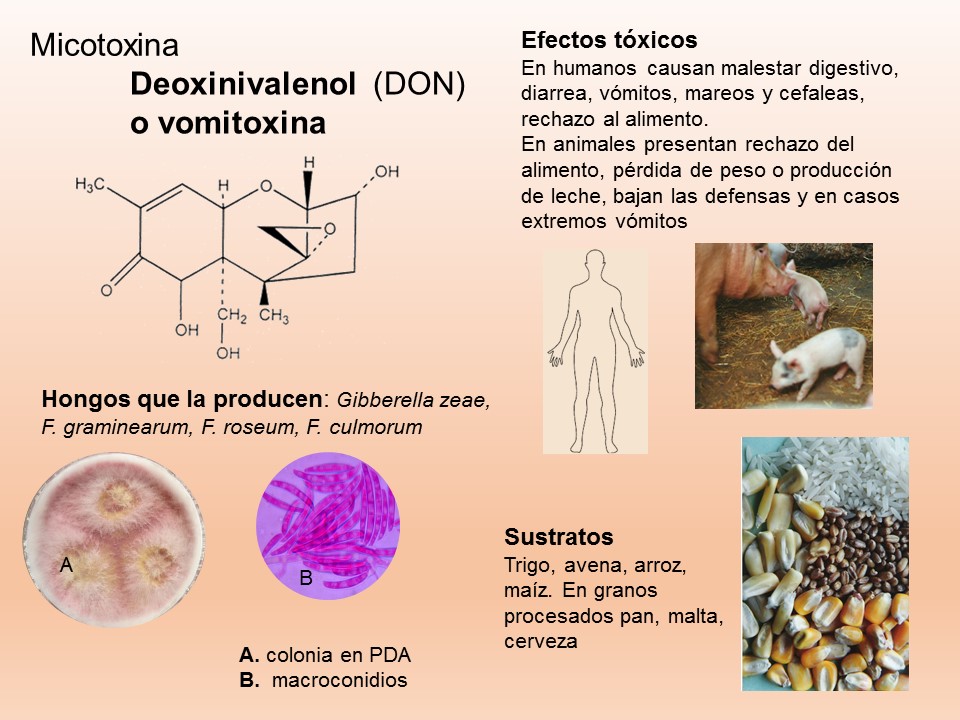
Las principales especies causantes de pudrición de raíz en plantas de trigo a nivel mundial son F. culmorum, F. graminearum, F. pseudograminearum, F. avenaceum, F. acuminatum, F. crookwellense y F. poae. En México, se reporta a Fusarium graminearum, F. avenaceum, F. equiseti como las especies asociadas a síntomas de pudrición de raíz y tizón de la espiga en algunas zonas trigueras.
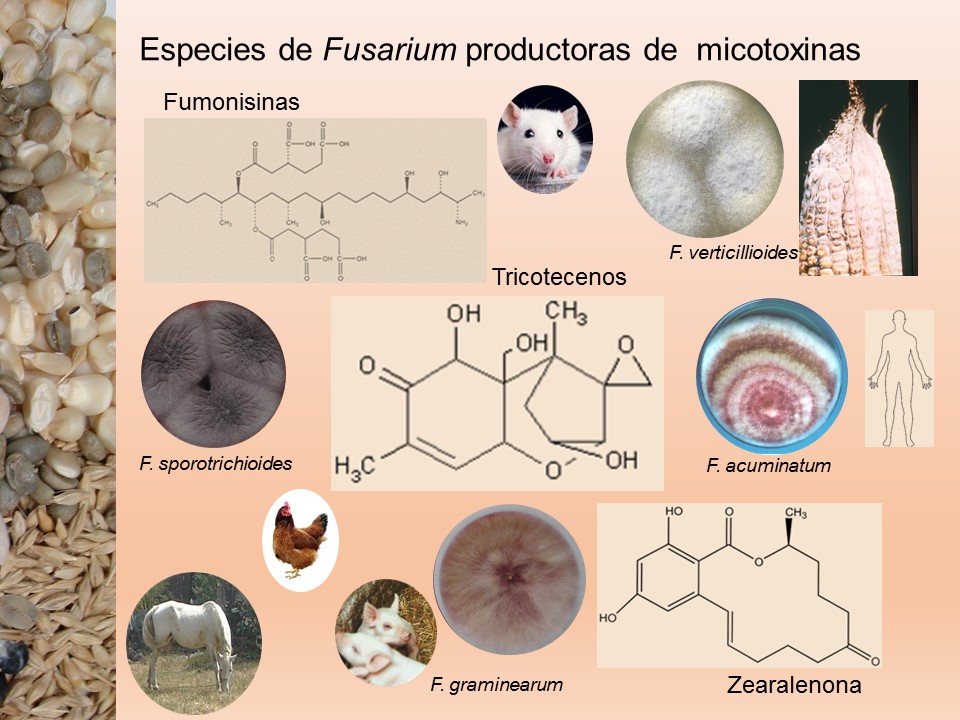
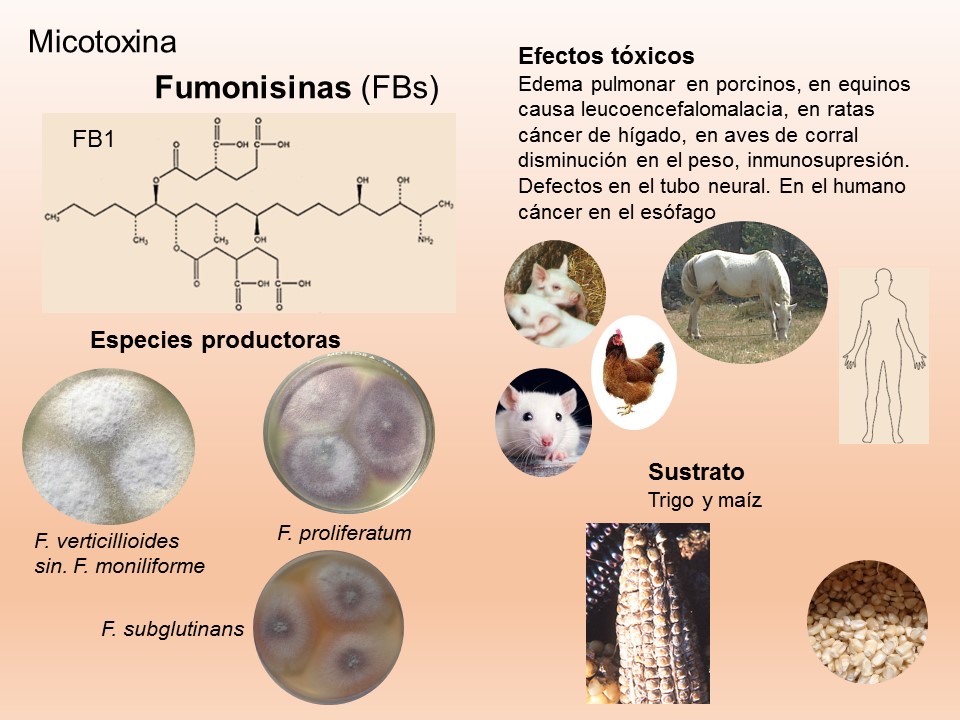
Las enfermedades causadas por Fusarium spp. se encuentran prácticamente en todas las áreas del mundo donde se produce maíz y trigo pueden ser muy agresivas en climas húmedos; en las zonas donde la humedad es baja, la infección la causa casi de manera típica, el inóculo presente en residuos de cereales infectados que permanecen en el suelo. El patógeno invade directamente la base de los tallos, cerca o debajo de la superficie del suelo, o entra a la planta a través de las raíces. Por lo tanto, el género Fusarium es considerado un problema agrícola importante, debido a que reduce la calidad y el rendimiento de los productos. Además, de producir metabolitos secundarios, llamados micotoxinas, responsables de enfermedades graves en los seres humanos y los animales.
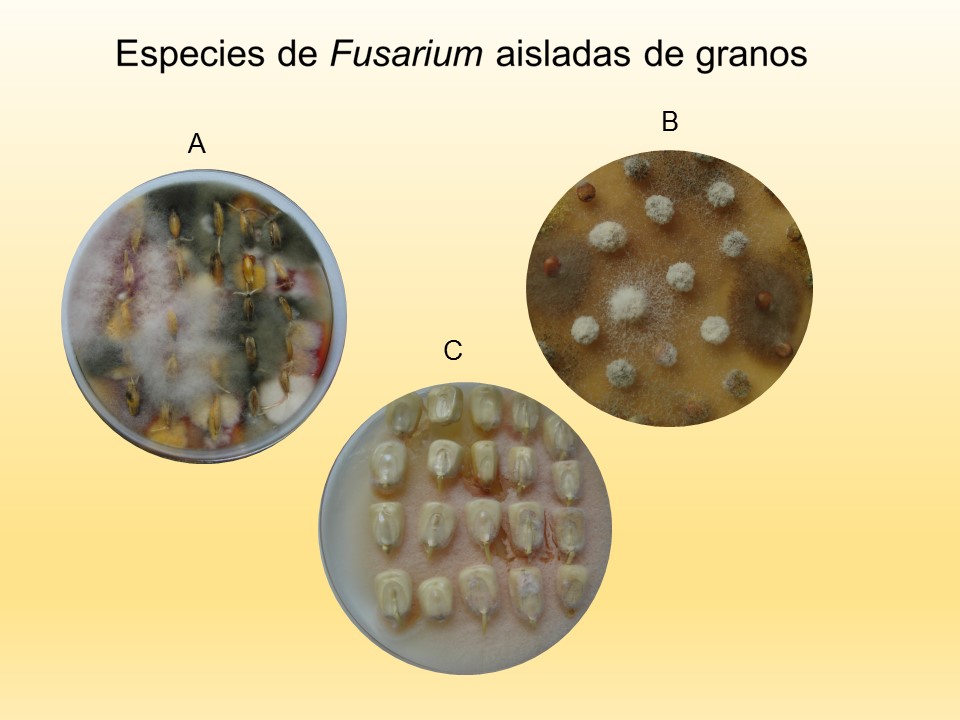
Figura 4. A. grano de trigo, B. sorgo, C. maíz.