El género Aspergillus presenta una distribución cosmopolita comprende aproximadamente 350 especies aceptadas, pueden crecer y degradar una gran variedad de sustratos e incluso causar micosis en el humano y animales. Debido al gran número de enzimas que producen, ácidos orgánicos y metabolitos bioactivos, tienen gran importancia en biotecnología. A diferencia de los hongos de campo, la principal característica de las especies del género Aspergillus, es su habilidad para invadir granos, semillas y alimentos con contenidos de humedad relativamente bajos, como es el caso de los cereales con un mínimo del 13.0% y en oleaginosas de 8 a 9%. Estos hongos pueden crecer en un amplio rango de temperaturas de 0 a 55°C. Con pocas excepciones, los hongos de almacén infectan a las semillas antes de la cosecha, una de estas excepciones, y desafortunadamente de gran importancia, es la invasión de maíz por la especie Aspergillus flavus, productor de potentes toxinas carcinógenas, llamadas aflatoxinas.

Figura 1. Colonias de Aspergillus flavus y A. niger en frijol.

Figura 2. Colonia de Aspergillus flavus en maíz.
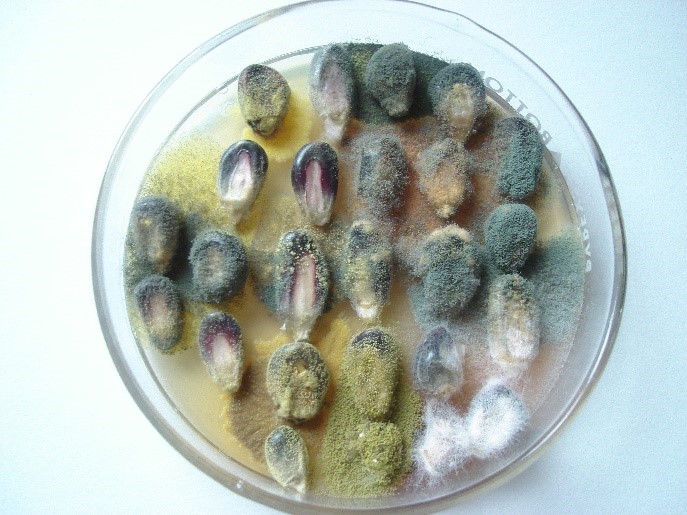
Figura 3. Micobiota de maíz azul en MSA.
Si los granos no se cosechan a tiempo, están expuestos a ser invadidos por los hongos de almacén, dado que el grano empieza a perder humedad y es dañado por los insectos de almacén. Es importante considerar que el almacenamiento prácticamente empieza cuando los granos alcanzan su madurez fisiológica, lo cual sucede antes de la cosecha, razón por la cual, hay que cosechar los granos y las semillas al momento en que éstos alcanzan su madurez fisiológica. Los principales daños ocasionados por los hongos de almacén cuyo hábitat natural generalmente son las bodegas, silos y trojes son: 1) reducción del poder germinativo; 2) ennegrecimiento total o parcial de los granos y semillas (particularmente de los embriones); 3) calentamiento y hedor; 4) diversos cambios bioquímicos; 5) pérdida de peso; y 6) producción de micotoxinas, las que al ser ingeridas pueden ser dañinas, ocasionando diversos trastornos llamados micotoxicosis, a veces severos, en los animales y humanos que consumen dichos granos o alimentos contaminados.

Figura 4. Ennegrecimiento causado por hongos de almacén.

Figura 5. Pérdida de germinación causada por A. niger.

Figura 6. Grano de maíz con presencia de mohos e insectos.
Morfología.
Las especies del género Aspergillus para su identificación se pueden distinguir teniendo en cuenta algunas características de su macro y micromorfología en diferentes medios de cultivo.
Macromorfología
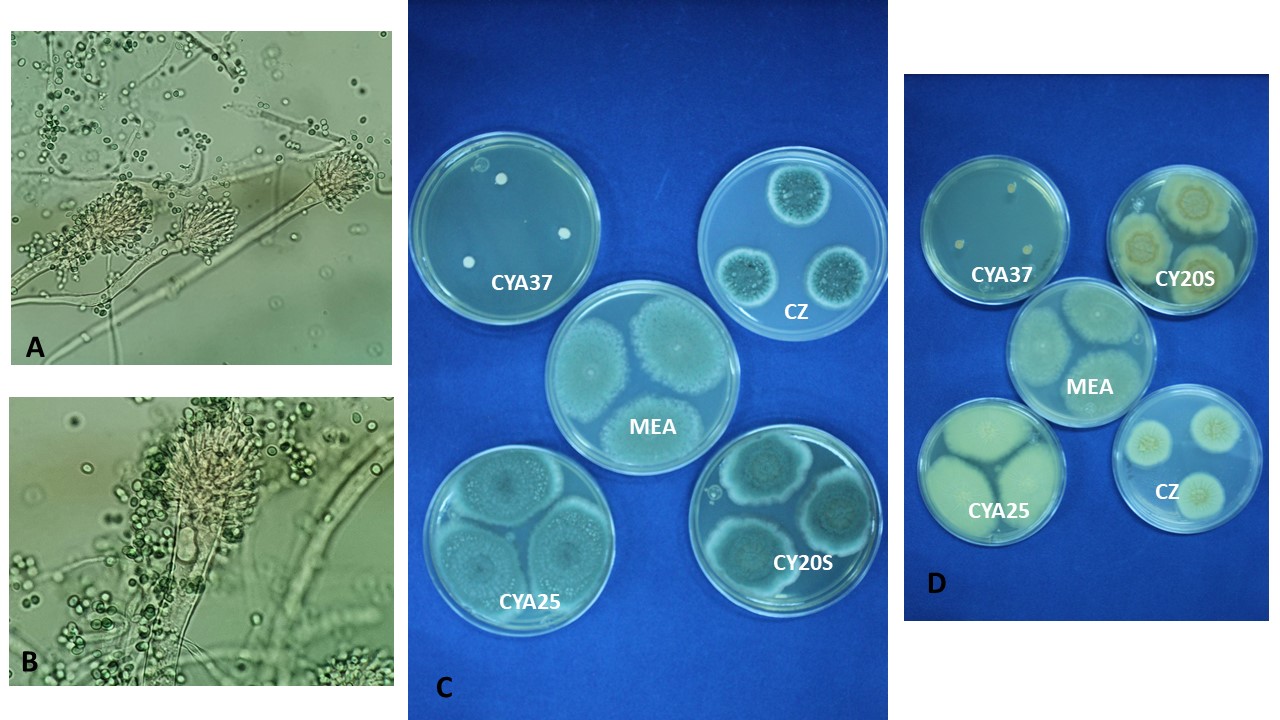
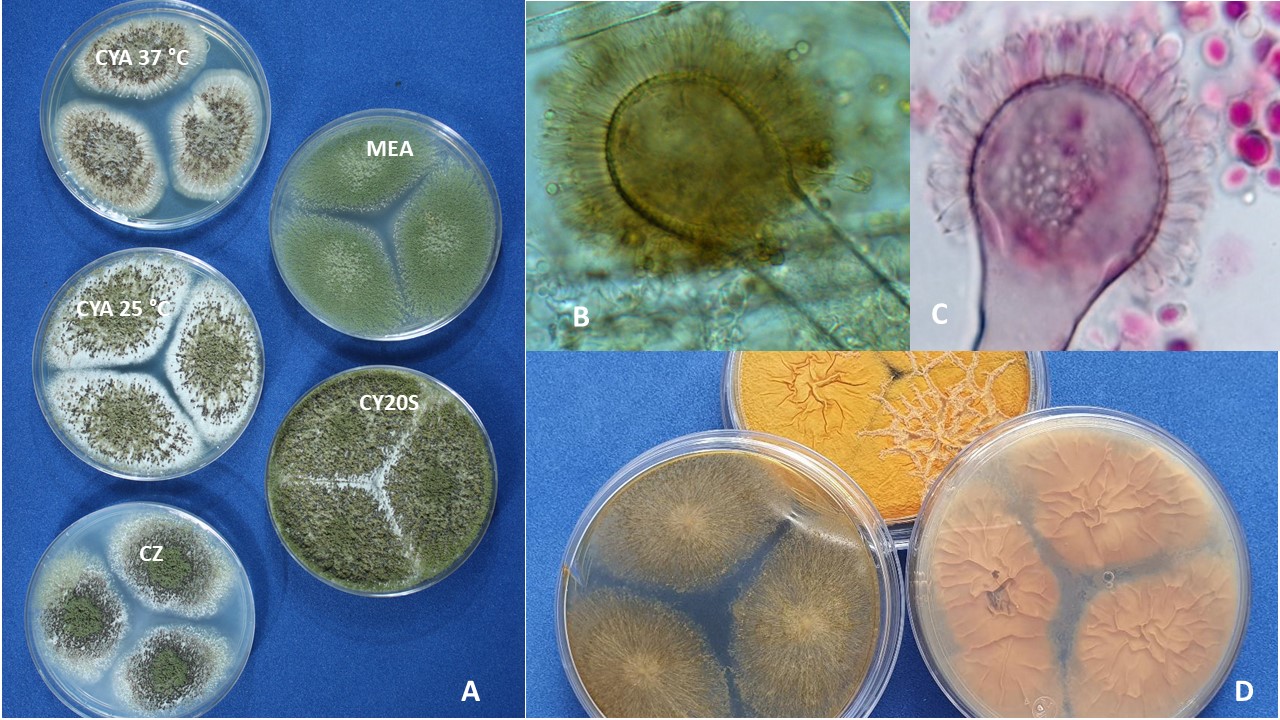
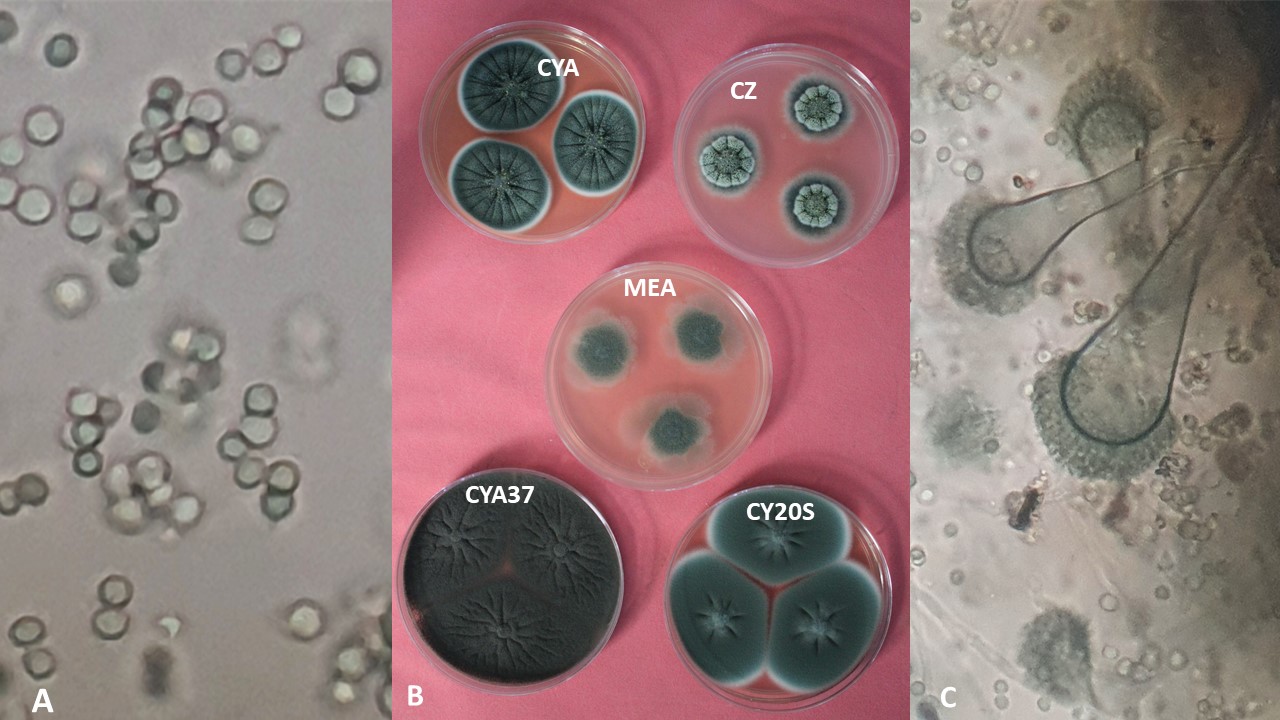
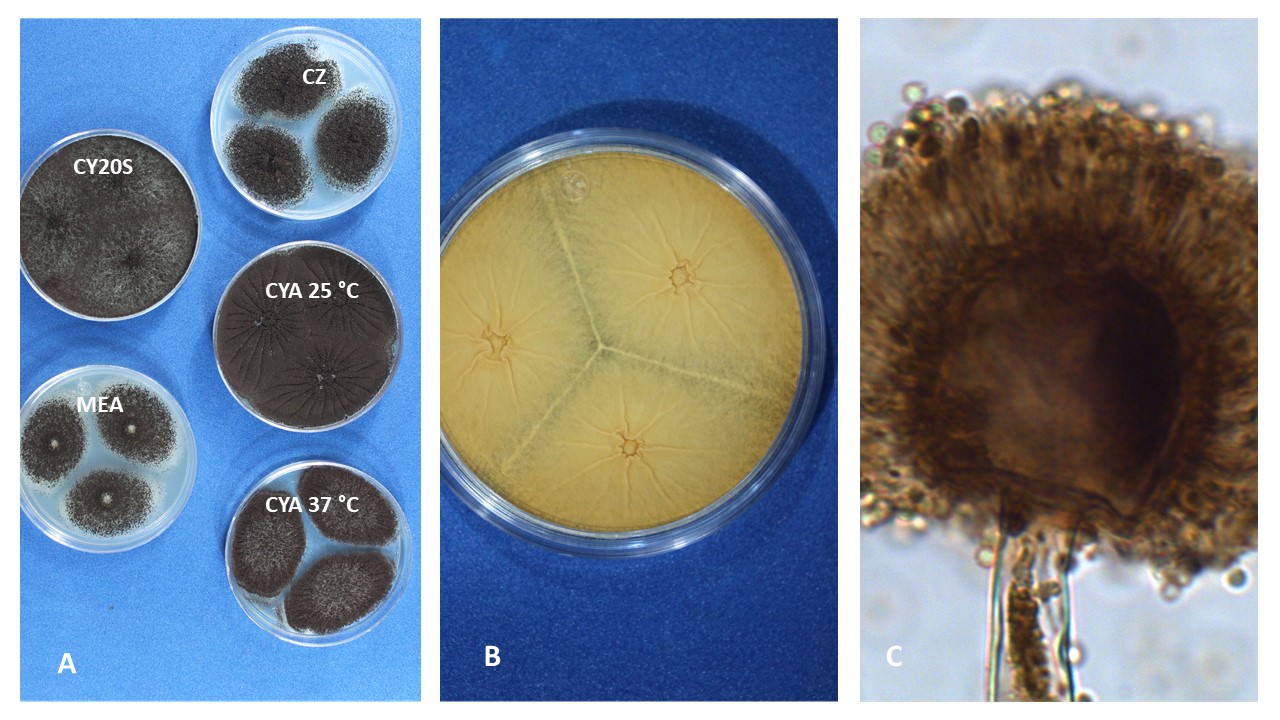
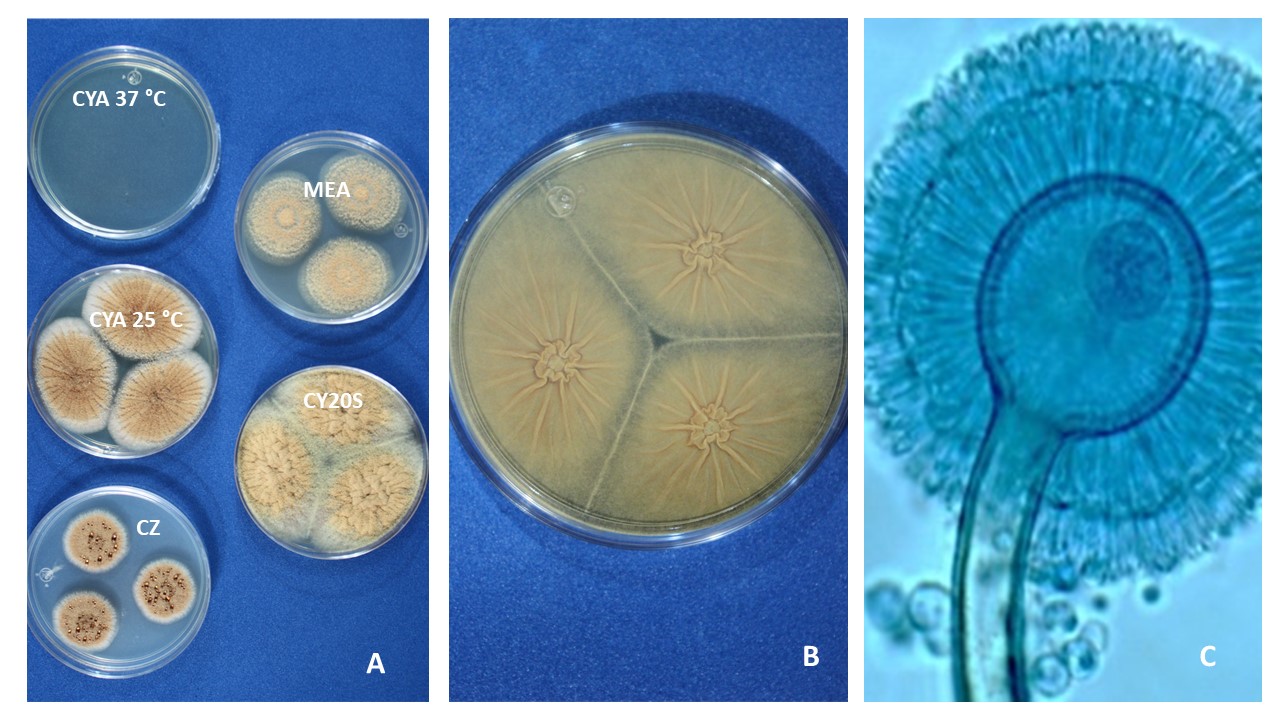
Color. El color de las cabezas conidiales que se observa en los diferentes medios de cultivo para su identificación varía de acuerdo con el tipo de especie, desde tonalidades claras hasta oscuras (blanco, amarillo, ocre, canela, azul verde, café hasta casi negro, entre otros).
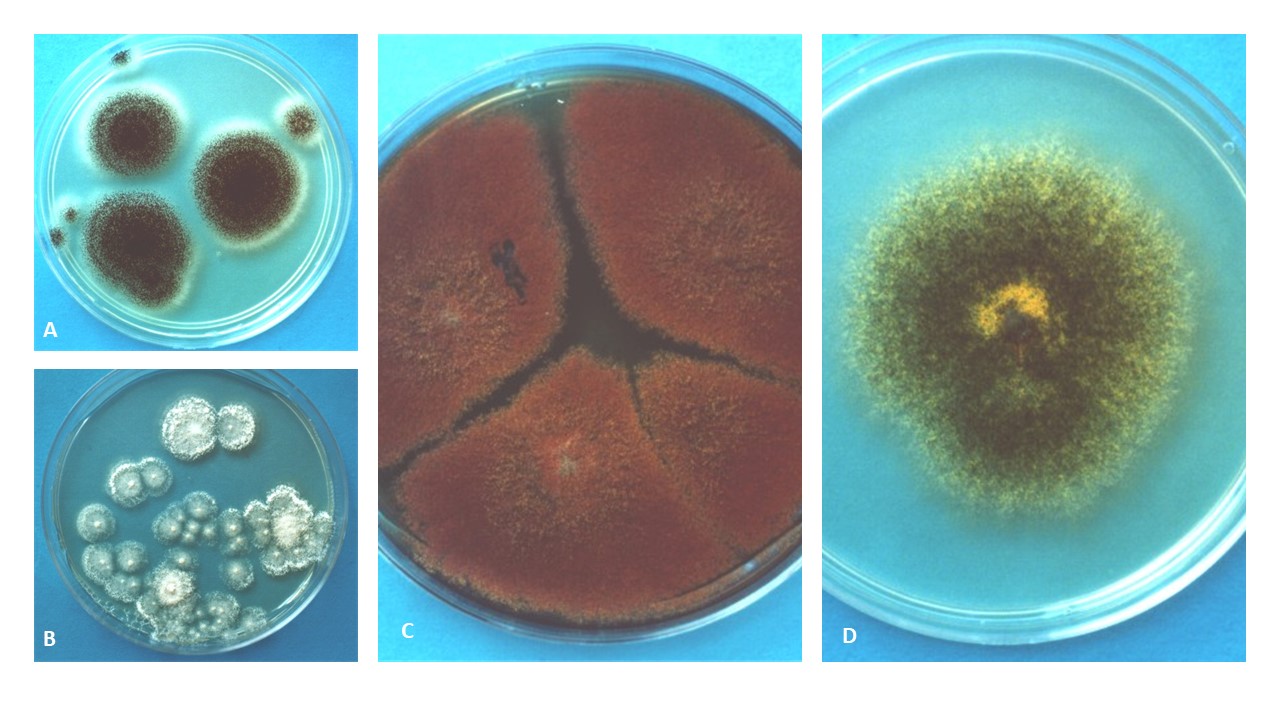
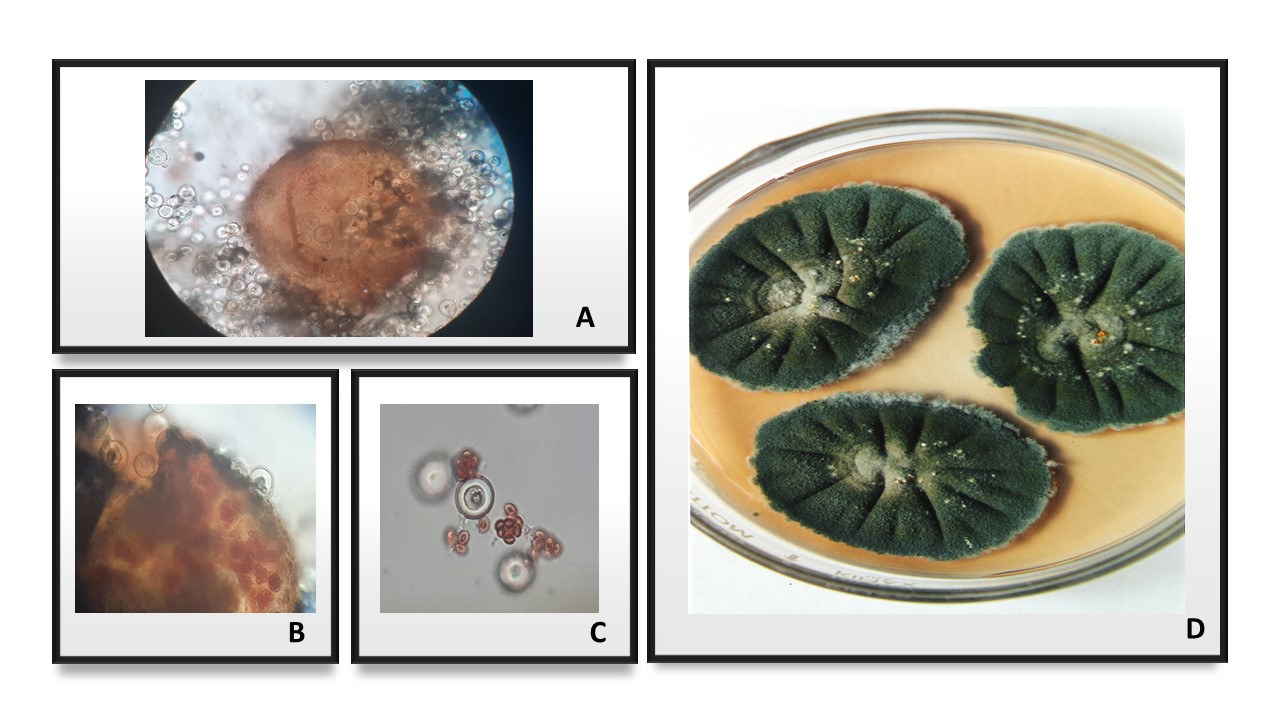
Figura 7. Colonias de A. Aspergillus niger. B. Aspergillus candidus. C. Eurotium rubrum y D. Eurotium herbariorum mostrando diferentes tonalidades en MSA
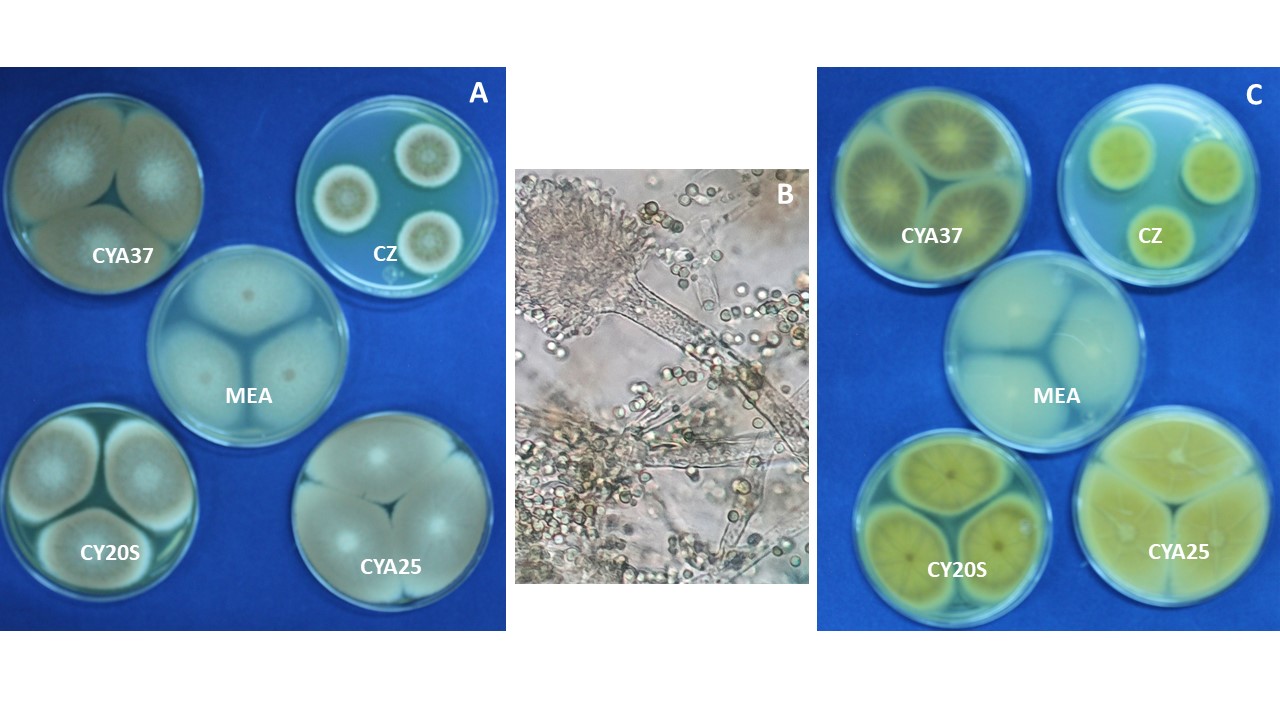
Diámetro de la colonia. El diámetro de la colonia en diferentes medios de cultivo, es otra característica fisiológica importante ya que dependiendo de su composición, de la actividad de agua (aw) y temperatura, su crecimiento puede variar.
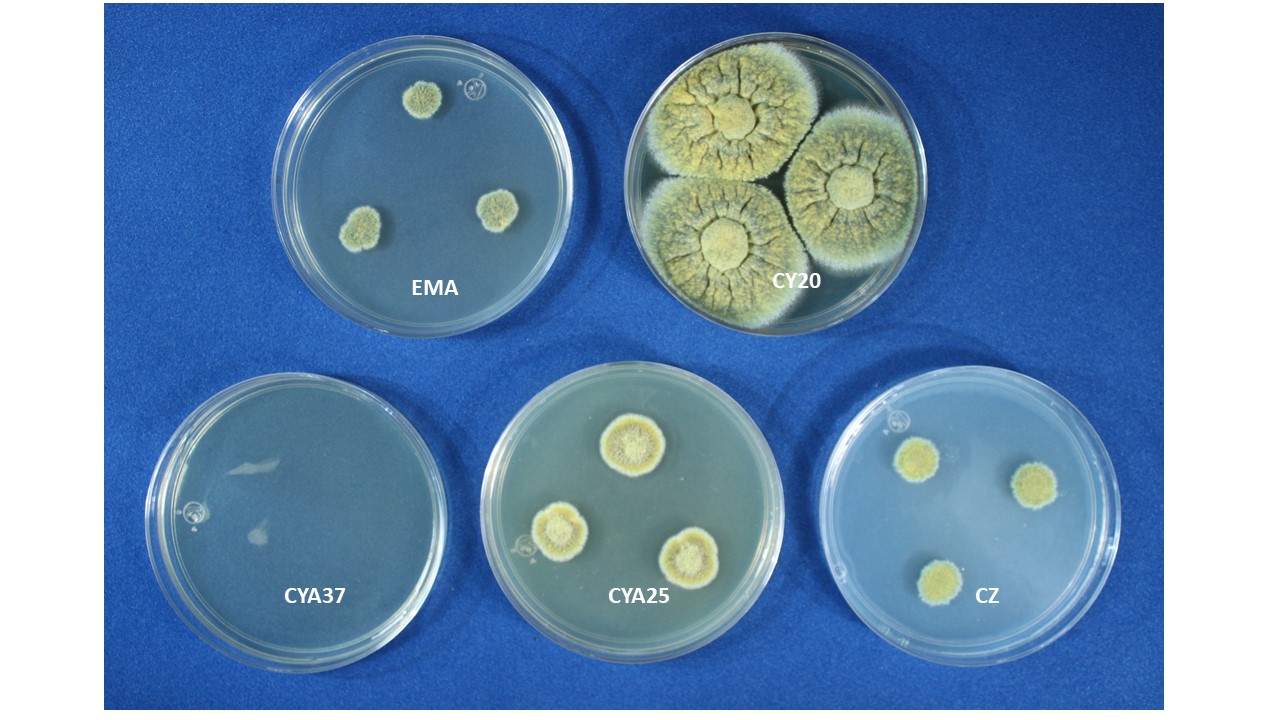
Figura 8. Eurotium sp. creciendo en diferentes medios de cultivo.
Textura y aspecto. La textura de las colonias por el anverso puede variar desde flocosa, lanosa, velutinosa, granular o combinación de éstas. Por su aspecto pueden ser planas, radialmente sulcadas, zonadas y plegadas. El reverso dependiendo de la especie y el tipo de medio de cultivo en donde esté creciendo, puede presentarse desde hialino hasta tonalidades de amarillo, naranja, café, entre otras. El color del micelio generalmente es blanco pero algunas especies presentan tonalidades distintivas.
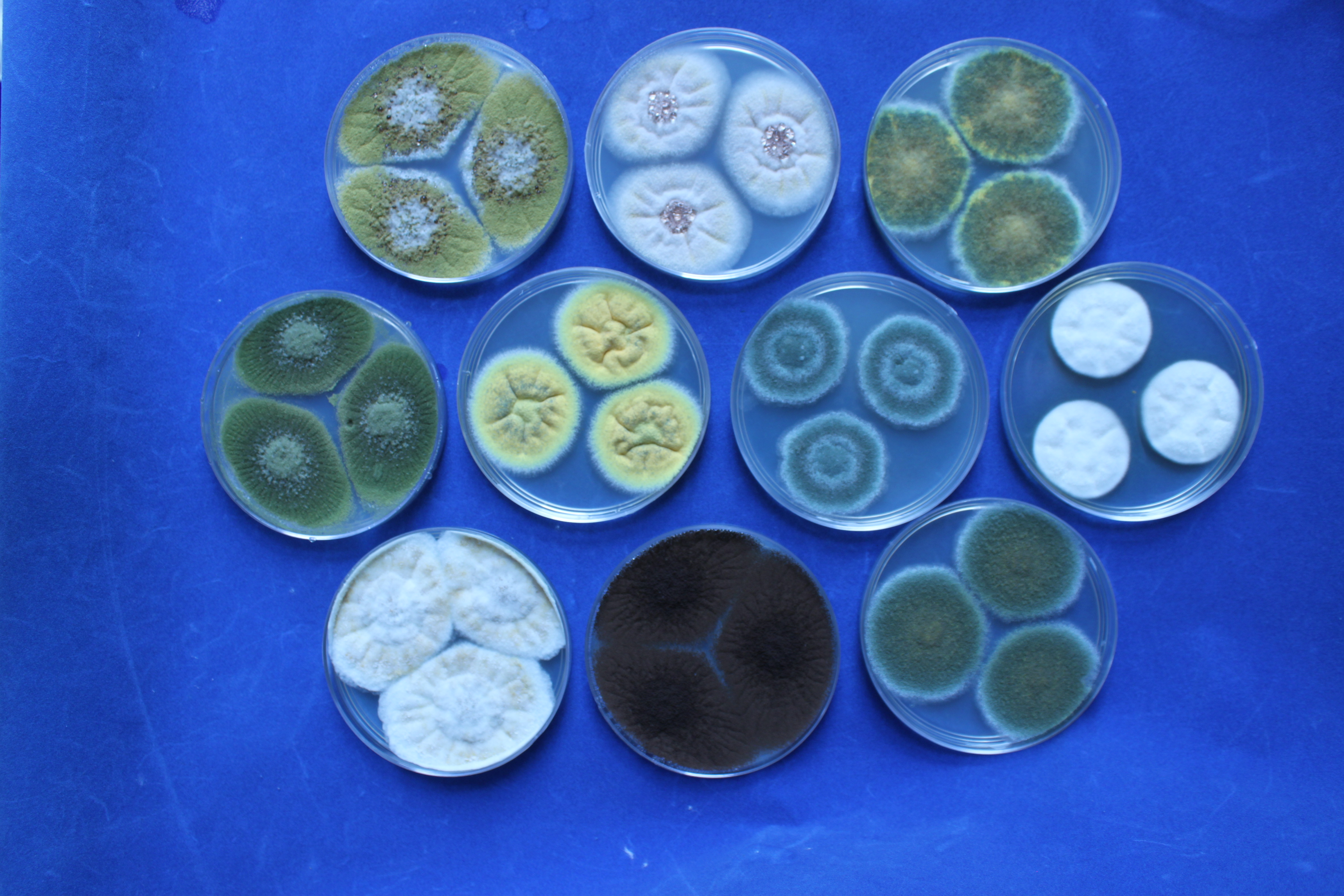
Figura 9. Textura y aspecto de colonias de Aspergillus spp. 1. Colonia de lanosa a flocosa, radialmente sulcada. 2. Colonia velutinosa, sulcada. 3. Colonia velutinosa a flocosa, plana. 4. Colonia velutinosa a flocosa, sulcada. 5. Colonia velutinosa, sulcada a plegada. 6. Colonia flocosa, zonada. 7. Colonia velutinosa, sulcada. 8. Colonia lanosa, sulcada. 9. Colonia granulosa a flocosa, sulcada. 10. Colonia flocosa plana.
Exudados. Algunas especies producen exudados los cuáles se observan como gotas de líquido sobre la superficie de las colonias, pueden ser hialinos o con diferentes tonalidades.

Figura 10. A. Colonias de Aspergillus flavus con exudados café rojizo. B. Colonias de Aspergillus carbonarius con exudados hialinos. C. Colonias de Aspergillus ochraceus con exudados de color ámbar.
Pigmentos solubles. En algunas especies se producen pigmentos que se difunden en el medio, cercano a los márgenes de las colonias.
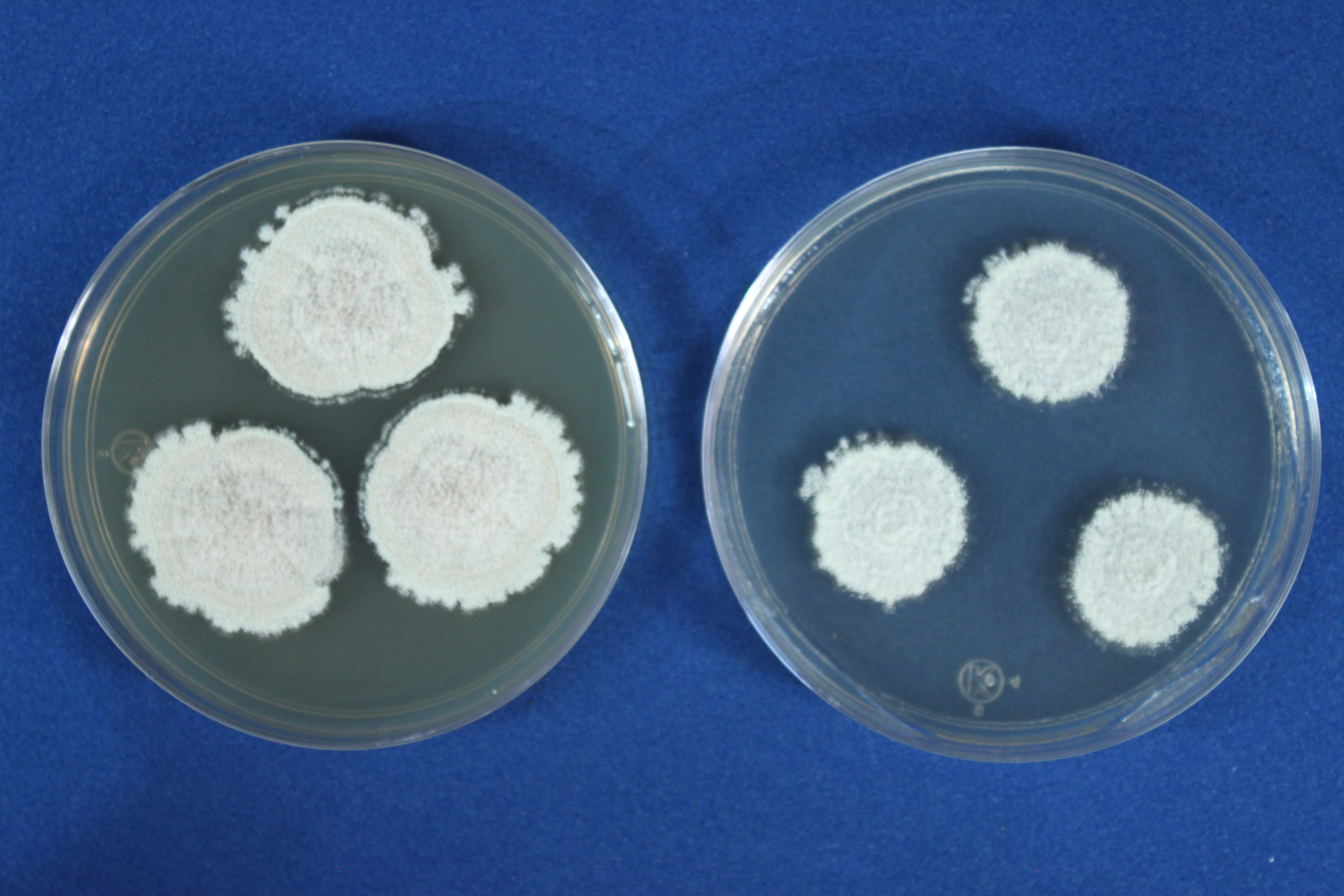
Figura 11. Imagen izquierda de Aspergillus candidus en CYA con presencia de pigmentos solubles en el medio de cultivo. Imagen derecha creciendo en MEA.
Esclerocios. La presencia de esclerocios es común en algunas especies que corresponden a las Secciones Flavi, Nigri, Circumdati y Candidi.
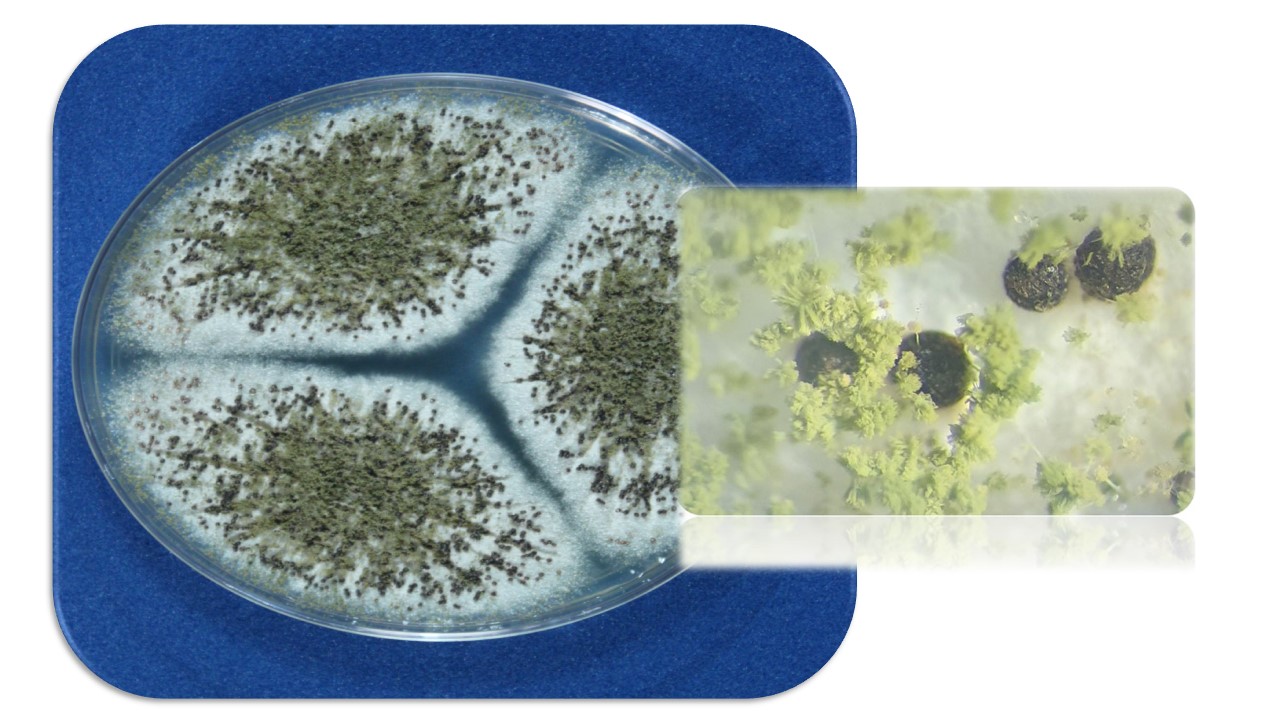
Figura 12. Esclerocios de Aspergillus flavus
Micromorfología
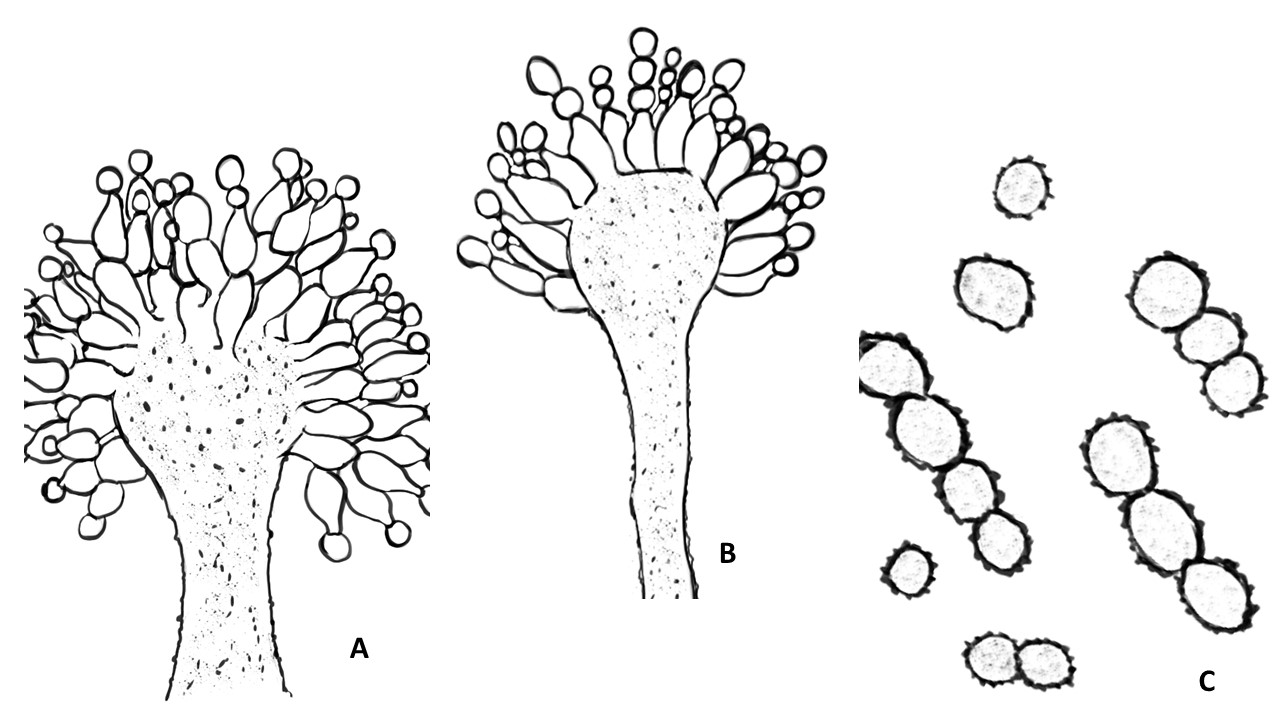
El género Aspergillus se caracteriza por presentar una reproducción asexual (estado anamorfo) formando conidios en conidióforos con una vesícula terminal a partir de la cual se forman las fiálides en las especies monoseriadas, o una hilera de métulas y sobre éstas otra de fiálides en las especies biseriadas. Los conidios por su origen son blásticos y catenulados basípetos, se les conoce como fialoconidios. Al conjunto de conidios con la vesícula se le denomina cabeza conidial. En algunos aspergilos se ha encontrado la fase sexual (estado teleomorfo), formando cleistotecios con ascas y ascosporas. Algunas especies presentan a partir del peridio o pared seudoparenquimatosa del cleistotecio las células de Hülle.
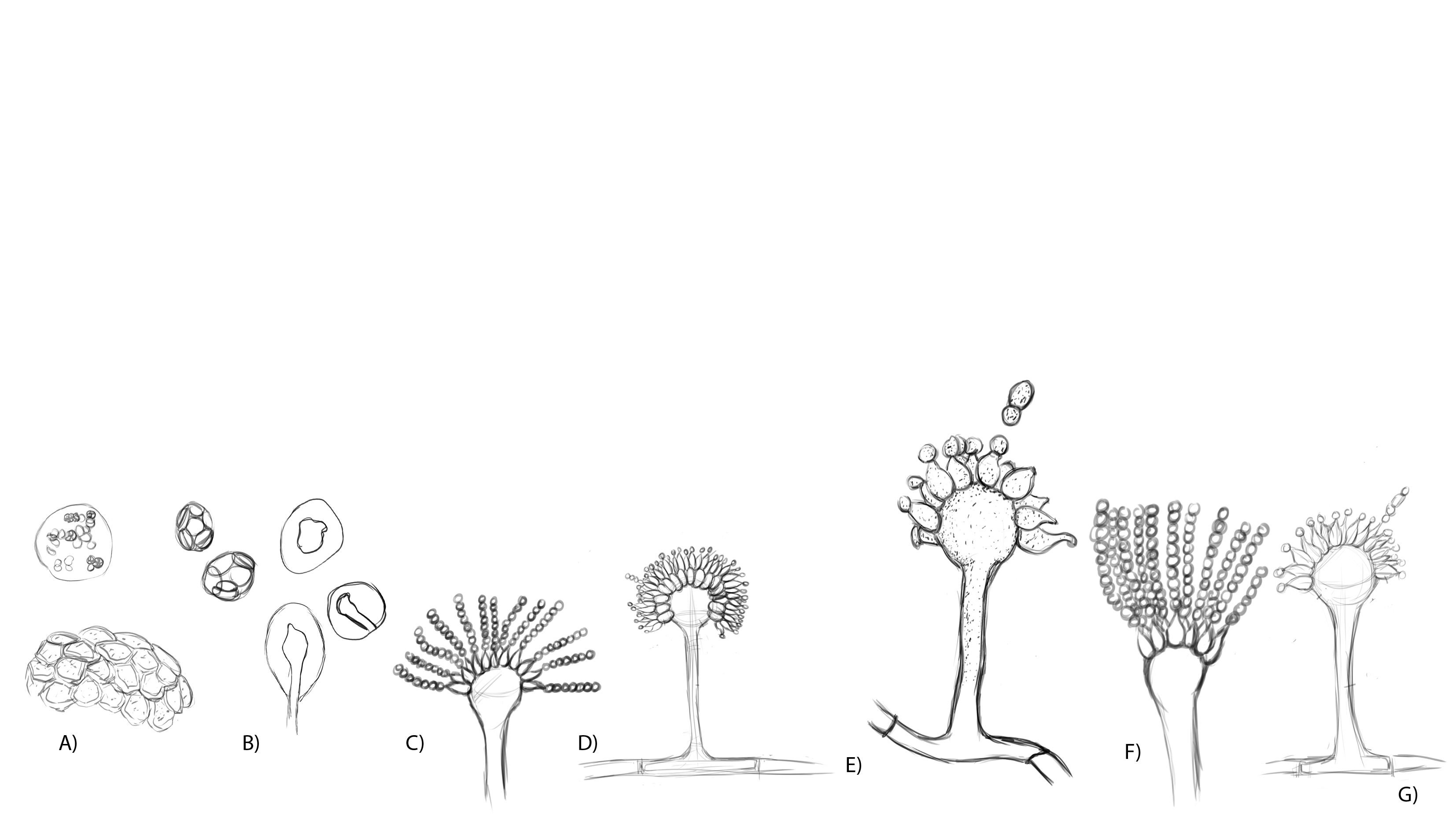
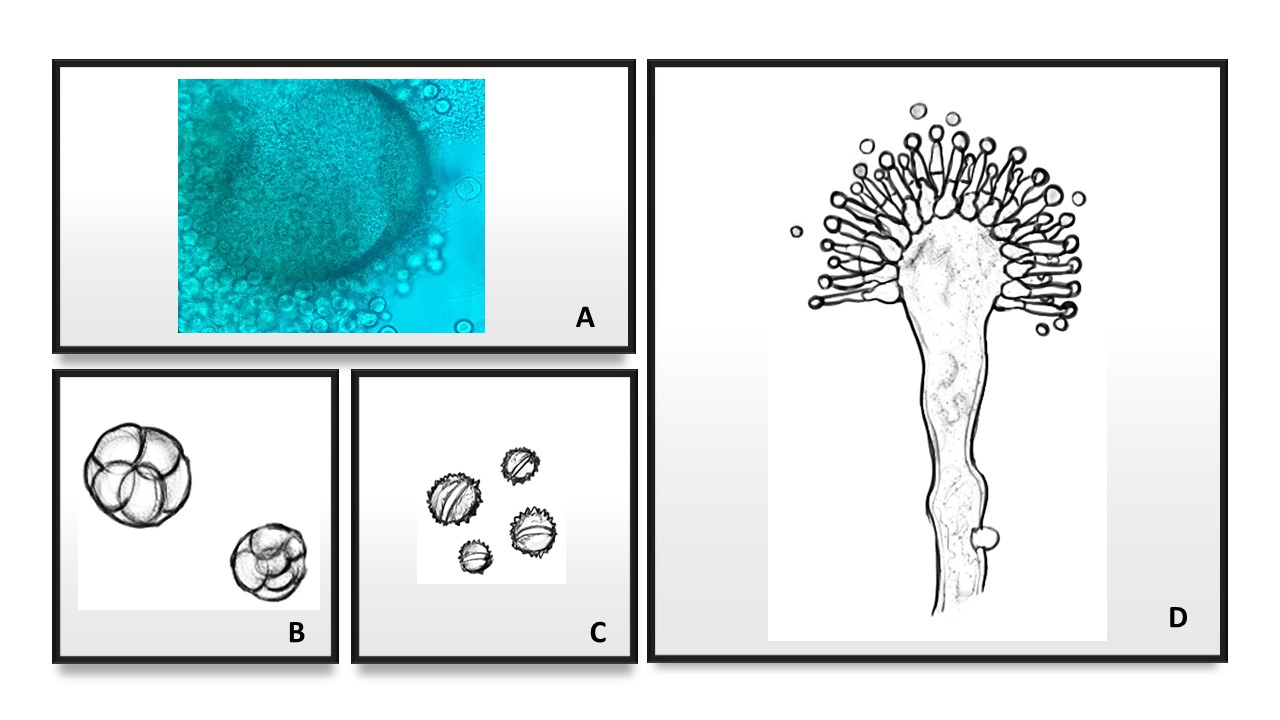
Figura 13. Micromorfología del género Aspergillus. A. Cleistotecio, ascas y ascosporas. B. Células de Hülle. C. Vesícula monoseriada. D. Vesícula biseriada. E. Vesícula globosa o esférica. F. Vesícula espatuliforme. G. Vesícula piriforme.
Conidióforo o estípite. Para la identificación de las especies de Aspergillus es importante considerar su longitud, textura y coloración.
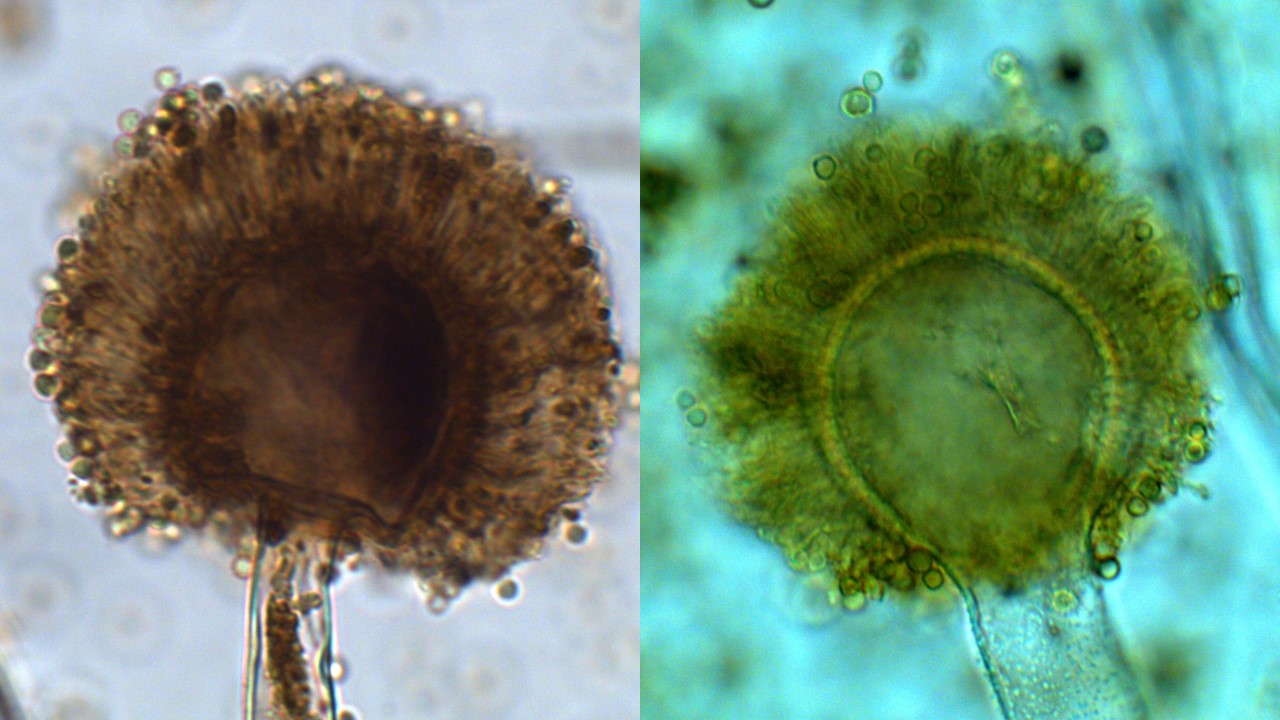
Figura 14. Conidióforo de Aspergillus niger con pared celular gruesa, lisa, hialina, ligeramente café en el ápice (imagen izquierda). Conidióforo con pared rugosa, hialina de Aspergillus flavus (imagen derecha).
Seriación. Los conidióforos terminan en una célula hinchada llamada vesícula, la cual dependiendo de cada especie puede ser de dos tipos: biseriada formada por una capa de células llamadas métulas directamente sobre la vesícula y a partir de las métulas se forman las células conidiógenas llamadas fiálides, que dan origen a los conidios. Las vesículas uniseriadas forman las fiálides directamente de la vesícula. Algunas especies pueden ser biseriadas y/o uniseriadas.
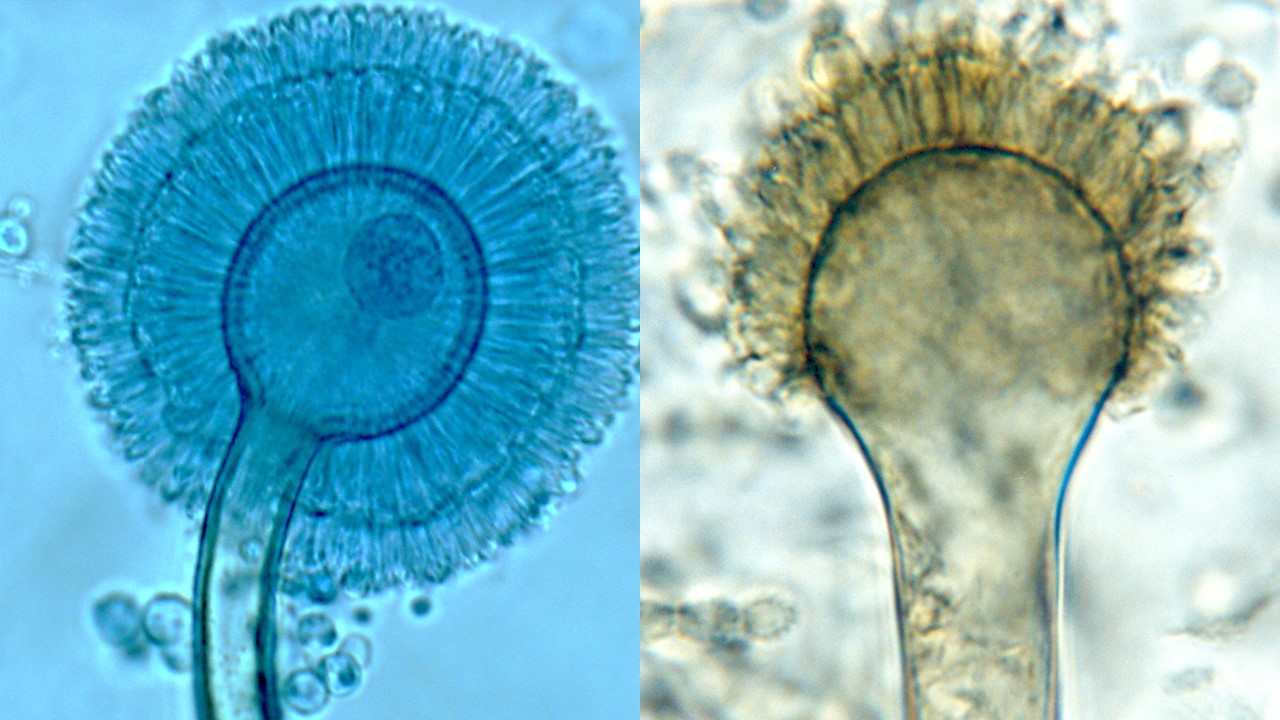
Figura 15. Vesícula biseriada de Aspergillus ochraceus (imagen derecha). Vesícula monoseriada de Eurotium sp. (imagen izquierda).
Vesícula. La forma de la vesícula es una característica importante para distinguir las especies, pueden ser esferoidales, piriformes, espatuliformes o claviformes.
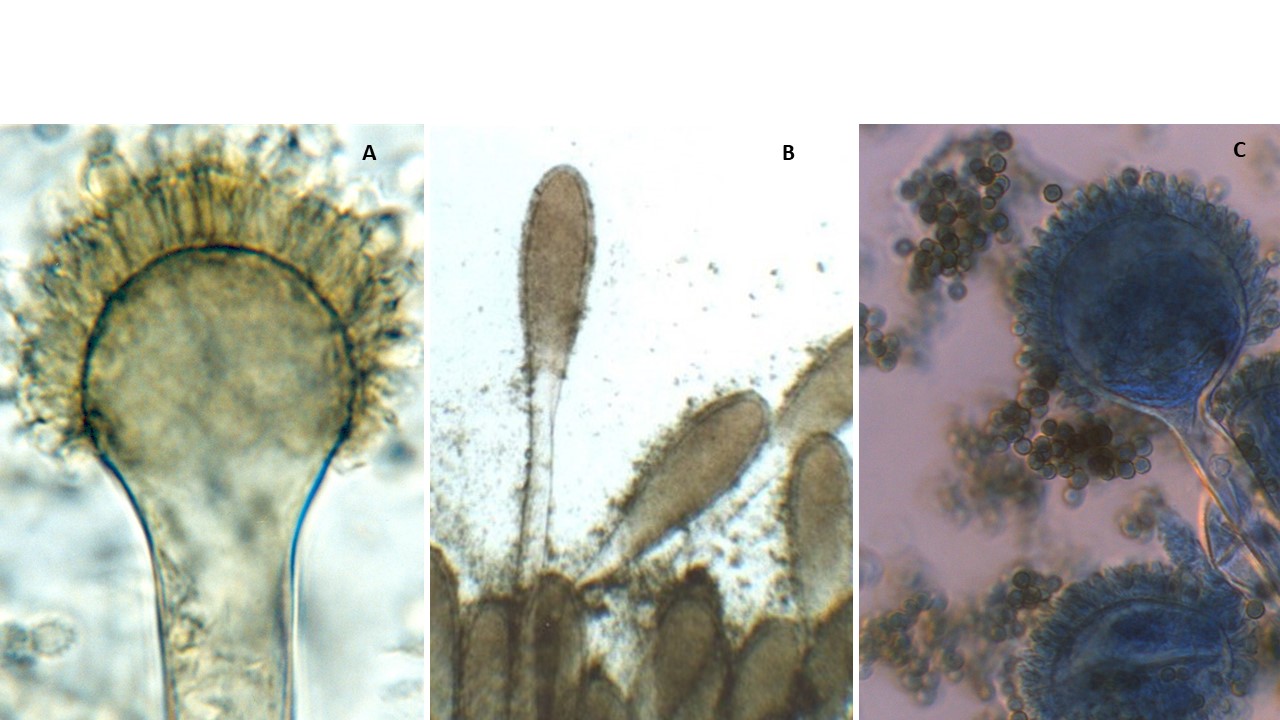
Figura 16. Morfología de las vesículas del género Aspergillus. A. Vesícula piriforme de Eurotium sp. B. Vesícula claviforme de Aspergillus clavatus. C. Vesícula esferoidal de Aspergillus parasiticus.
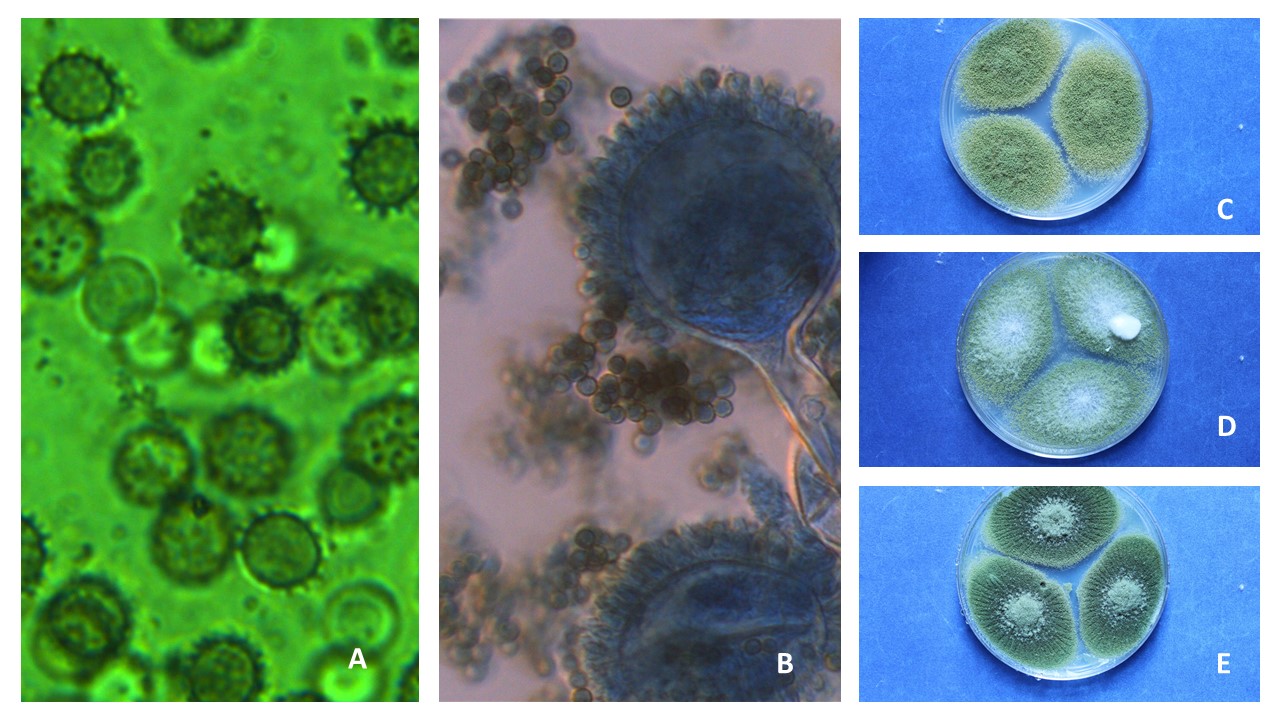
Conidios. La forma, el tamaño y la textura de los conidios son características determinantes para diferenciar especies.
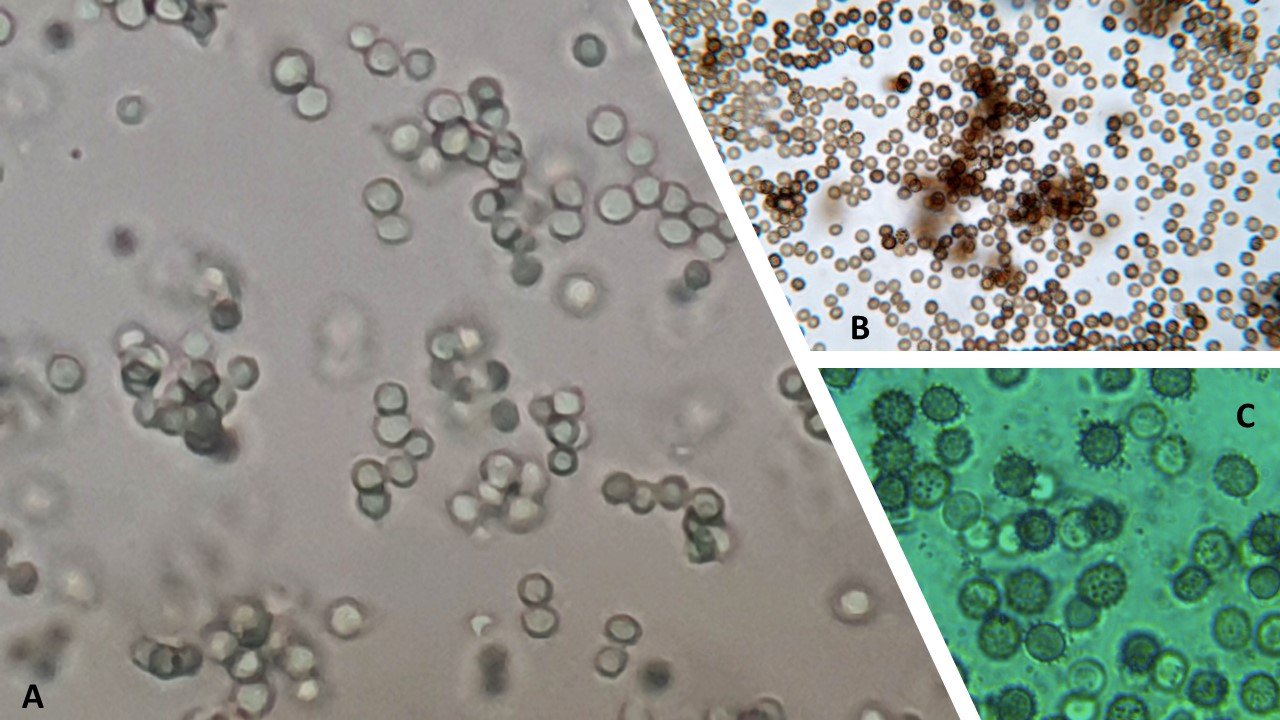
Figura 17. A Conidios globosos o elipsoidales con pared lisa de A. fumigatus. B. Conidios globosos con pared equinulada de A. carbonarius. C. Conidios globosos con pared equinulada de Aspergillus parasiticus.
Cleistotecios. Algunos estados sexuales o teleomorfos de Aspergillus como Eurotium, Emericella y Neosartorya se observa la formación de ascomas cerrados llamados cleistotecios, que contienen ascas globosas distribuidas irregularmente con ascosporas, sin presencia de un himenio.
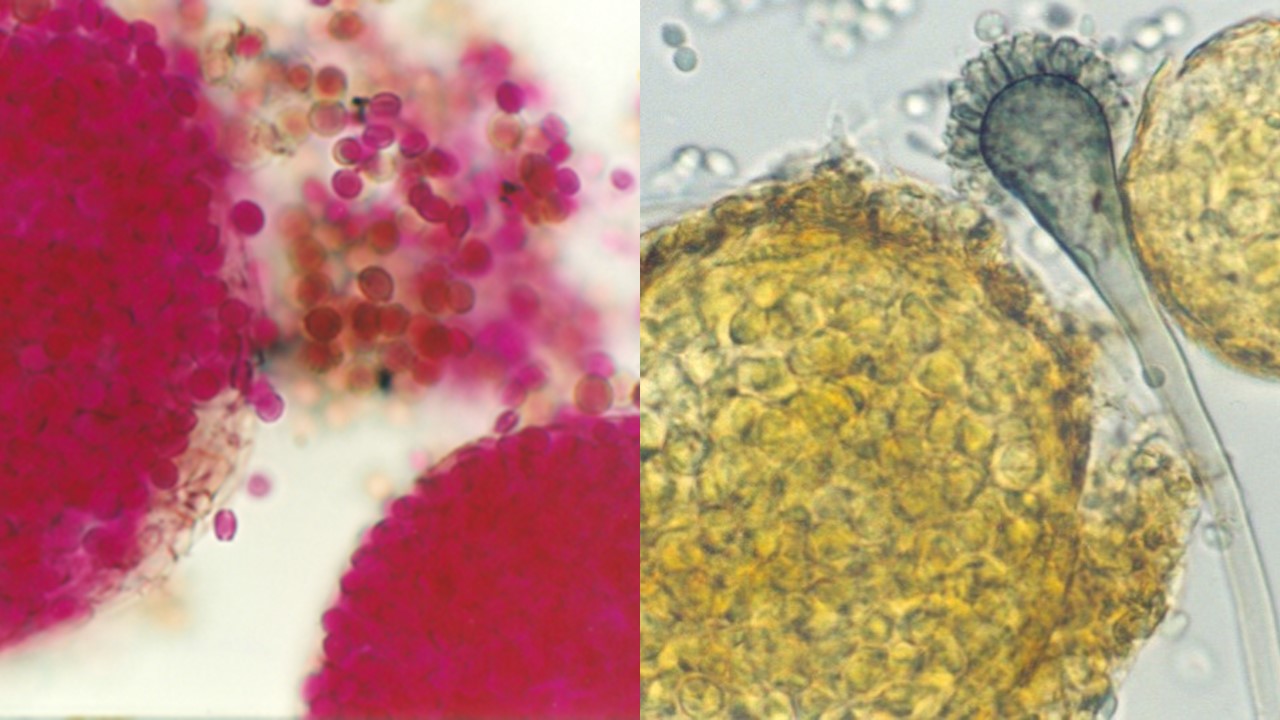
Figura 18. Cleistotecios de Eurotium spp., en la imagen derecha se observa el estado holomorfo (fase asexual y sexual).
Ascosporas. Las ascosporas pueden presentar diferentes tamaños, colores y ornamentaciones
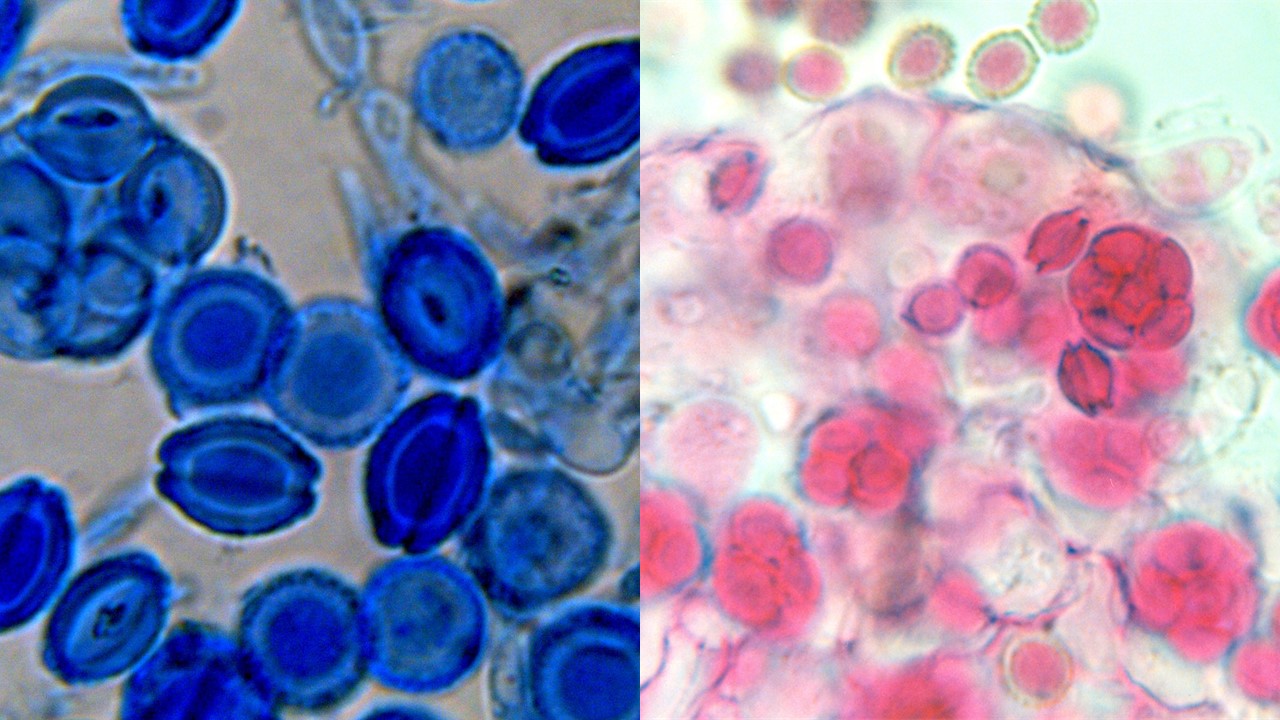
Figura 19. Ascas y ascosporas de pared lisa sin surco de Eurotium herbariorum teñidas con azul de algodón (imagen izquierda). Asacas y ascosporas con surco y crestas de Eurotium chevalieri teñidas con lactofucsina (imagen derecha).
Células de Hülle. Algunas especies presentan estas células de pared gruesa rodeando el peridio seudoparenquimatoso del cleistotecio, como en Emericella nidulans.
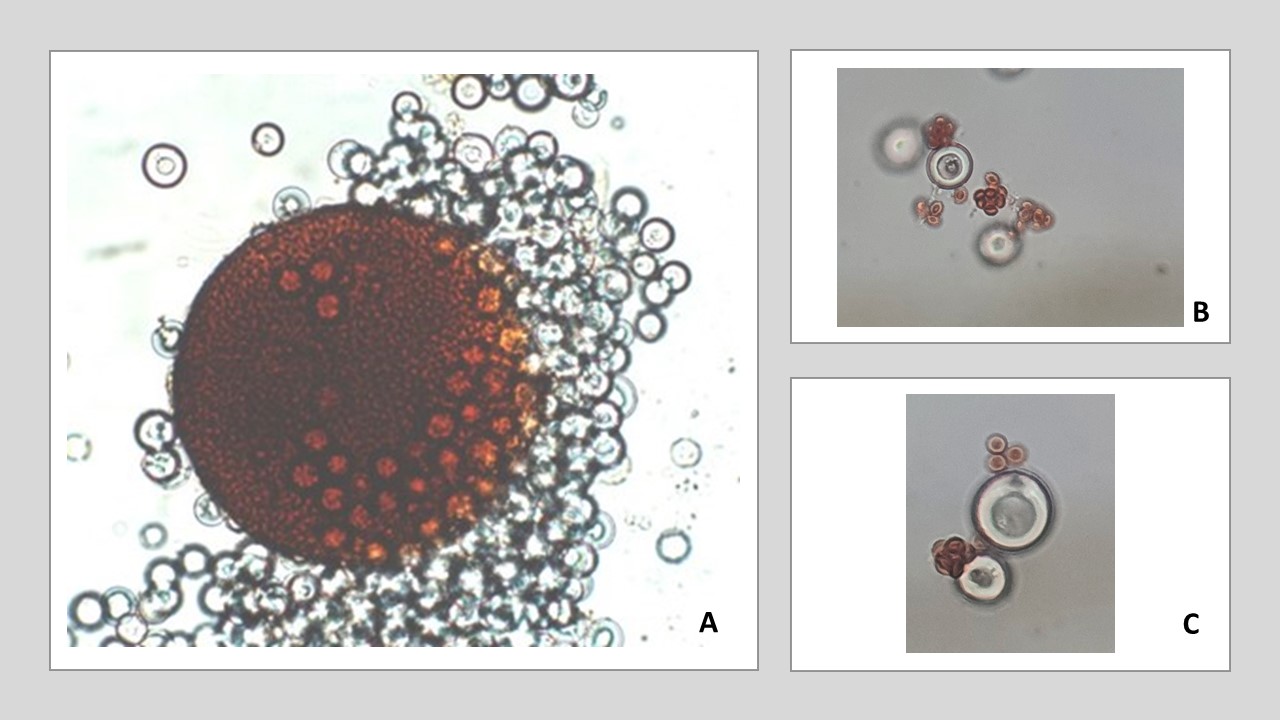
Figura 20. A. Cleistotecio y células de Hülle de Emericella nidulans. B. y C. Células de Hülle, ascas y ascosporas
Taxonomía del género Aspergillus
El género Aspergillus fue clasificado por Raper y Fennell (1965), en 18 grupos y 132 especies. Posteriormente Samsom y Gams (1985) propusieron una nueva nomeclatura y taxonomía agregando nuevas especies de acuerdo con el Código Internacional de Nomeclatura Botánica (CINB) y lo dividieron en siete subgéneros, cada uno de los cuales están subdivididos, a su vez, en una o más secciones considerando los estados teleomorfos. Frisvad et al. (2005) propusieron la sección Ochraceorosei para ubicar a las especies A. ochraceoroseus y A. rambelii. Aspergillus y sus teleomorfos actualmente son estudiados considerando sus características morfológicas, fisiológicas y aspectos moleculares.
En el Cuadro 1. se cubrieron las secciones del género Aspergillus que inciden en granos, semillas almacenadas y sus derivados.
Cuadro 1. Subgéneros y Secciones del Género Aspergillus comunes en granos y semillas almacenados y sus derivados.
| Súbgenero | Características | Secciones |
|---|---|---|
| Aspergillus | Cabezas conidiales uniseriadas, osmofílicos. | Aspergillus (teleomorfo Eurotium) cabezas conidiales verde-azul, hifas de color amarillo o rojo, cleistotecios de color amarillo brillante en la mayoría de las especies. Restricti cabezas conidiales con cadenas de conidios sueltas o columnas compactas, a menudo largas delgadas y enrolladas, en tonos de verde; conidios cilíndricos cuando son jóvenes, con desarrollo lento en medio de cultivo, no presentan cleistotecios (Aspergillus restrictus). |
| Fumigati | Cabezas conidiales uniseriadas, vesículas piriformes. | Fumigati cabezas conidiales con cadenas de conidios arregladas en forma columnar compacta, en tonos que van de verde-gris pálido a verde-azul obscuro, no osmofílicos; cuando son jóvenes los conidios no son cilíndricos (Aspergillus fumigatus). Cervini cabezas conidiales naranja claro a gris-naranja, crecimiento escaso y una esporulación pobre en el medio Czapek (Aspergillus cervinus). |
| Ornati | Cabezas conidiales uniseriadas, vesículas subclavadas | Ornati cabezuelas conidiales de color verde-amarillo, verde-gris o verde-azul cuando son jóvenes, oscureciéndose en la mayoría de las especies (Aspergillus ornatus). |
| Clavati | Cabezas conidiales uniseriadas, vesículas clavadas | Clavati cabezas conidiales clavadas verde-azul, tornándose de color gris cuando están viejas (Aspergillus fumigatus). |
| Nidulantes | Cabezas conidiales biseriadas | Nidulantes esterigmas en dos series, comúnmente con células de Hülle globosas o subglobosas; cleistotecios en algunas especies; ascosporas de color rojo-anaranjado a violeta (Aspergillus nidulans). Versicolor cabezas conidiales de color verde-azul, verde- amarillo opaco, gris, de radiadas a columnares laxas; células de Hülle globosas a subglobosas (Aspergillus versicolor). Usti cabezas conidiales color oliva, gris-oliva, café obscuro; radiadas o columnares; células de Hülle alargadas o enrolladas (Aspergillus ustus). Terrei cabezas conidiales con conidios formando una columna compacta, color avellana a canela (Aspergillus terreus). Flavipedes cabezas conidiales con las cadenas de conidios en columnas no compactas, blancas, de color carne, crema pálido o pardo (Aspergillus flavipes). |
| Circumdati | Cabezas conidiales uni y/o biseriadas | Wentii cabezas conidiales en tono de color café-amarillo a pardo opaco, conidióforos lisos o ligeramente rugosos, sin color o ligeramente pigmentados (Aspergillus wentii). Flavi cabezas conidiales de color verde-amarillo brillante cuando son jóvenes, algunas veces se tornan de color café con la edad, radiadas y laxas (Aspergillus flavus). Nigri cabezas conidiales en tonos de color negro a café obscuro, conidióforos usualmente lisos o incoloros, o bien pigmentados debajo de la vesículas (Aspergillus niger). Circumdati cabezas conidiales, predominantemente biseriadas con tonos color amarillo, ocre o ante, conidióforos rugosos y a menudo pigmentados (Aspergillus ochraceus). Candidi cabezas conidiales, siempre de color blanco o crema, grandes de forma globosa o radiada, conidióforos lisos y sin pigmentación (Aspergillus candidus). Cremei cabezas conidiales grandes, radiadas, vesículas estrictamente globosas; conidióforos con una constricción definida debajo de la vesícula; sin esclerocios (Aspergillus cremeus). Sparsi cabezas conidiales gris pálido a oliva-ante (Aspergillus sparsus). |
Principales micotoxinas y su importancia
Aflatoxinas
La especie Aspergillus flavus es productora de aflatoxina B1, además de ácido ciclopiazónico, ácido 3-nitropropiónico, aspertoxina, ácido aspergílico. La especie Aspergillus parasiticus sintetiza las aflatoxinas B1, B2, G1 y G2. Las aflatoxinas fueron denominadas B (blue) y G (green) por su florescencia azul y verde bajo luz UV (365 nm) al ser determinadas por cromatografía de capa fina. Las aflatoxinas M1 y M2 (milk) son un derivado hidroxilado de aflatoxinas B1 o B2, fueron determinadas en la leche de vaca al consumir y metabolizar alimento contaminado con aflatoxinas B, consideradas por la Agencia Internacional de Investigación sobre el cáncer, por sus siglas en inglés IARC, como posibles carcinógenos (grupo 2). La aflatoxina B1 ha sido asociada a cáncer de hígado en el humano e incluso puede actuar de manera sinérgica con el virus de la hepatitis B. De acuerdo con la IARC, es considerada uno de los metabolitos secundarios cancerígenos más potentes que se conocen clasificados dentro del Grupo 1. Las aflatoxinas pueden determinarse en cereales como el maíz, trigo, sorgo, arroz; en oleaginosas como las nueces, cacahuates, pistaches, almendras, coco; en especias como el chile, jengibre, cúrcuma, pimienta.

Figura 21. Principales especies de mohos productores de aflatoxinas, sustratos y efectos en el humano y animales.
Esterigmatocistina.
Esta toxina no solo la sintetizan especies de Aspergillus como A. flavus, A. versicolor, Em. nidulans, Em. quadrilineata, Em. rugulosa, sino también, otros géneros como Bipolaris y Chaetomium. Es un intermediario de la biosíntesis de la ruta metabólica de las aflatoxinas, convirtiéndose en 3-metoxiesterigmatocistina y finalmente en aflatoxinas. Produce efectos mutágenos, citotóxicos y cancerígenos, sin embargo, es menos tóxica que las aflatoxinas. Se ha determinado en cereales y sus derivados, así como en granos de café, especias y quesos.

Figura 22. Principales especies de mohos productores de esterigmatocistina, sustratos y efectos en el humano y animales.
Ácido ciclopiazónico
Es producido por especies de Aspergillus y Penicillium como A. flavus, A. versicolor, A. oryzae, A tamarii, P. verrucosum, P. patulum, P. camembertii y P. paberulum. En A. flavus la producción de esta micotoxina generalmente se presenta con la síntesis de aflatoxinas. En animales de laboratorio se ha encontrado que causa necrosis en el hígado, páncreas, riñón, músculos y afecta al sistema nervioso en diversos animales. Se ha demostrado un efecto sinérgico cuando se presenta en maíz contaminado con aflatoxinas y ácido ciclopiazónico. En gallinas ponedoras se ha encontrado que produce huevos con cáscaras quebradizas, asimismo, se determinó en leche de ovejas alimentadas con alimento contaminado con esta micotoxina. Se sugiere que por la gran diversidad de especies que producen esta micotoxina, probablemente puede estar ampliamente distribuida en la naturaleza, presentándose en alimentos de origen animal como la carne, leche, quesos y embutidos, contribuyendo a la ingesta diaria y exposición a esta toxina.

Figura 23. Principales especies de mohos productores de ácido ciclopiazónico, sustratos y efectos en el humano y animales.
Ocratoxina A
Presenta efectos nefrotóxicos en el humano y animales. En la Península Balcánica (Bosnia y Herzegovina, Bulgaria, Croacia, Rumania, Serbia y Slovenia), causó una micotoxicosis llamada nefropatía endémica balcánica (BEN), provocando degeneración tubular, fibrosis intersticial, hialinización de los glomérulos, afectando la función renal. También se asocia a efectos cancerígenos en el tracto urinario. Es sintetizada por especies de Aspergillus ochraceus, A. carbonarius, A. niger, A. ostianus, A. melleus. Contamina alimentos como los cereales y sus derivados, granos de café, cacao, pasas, especias, vino y jugo de uva.
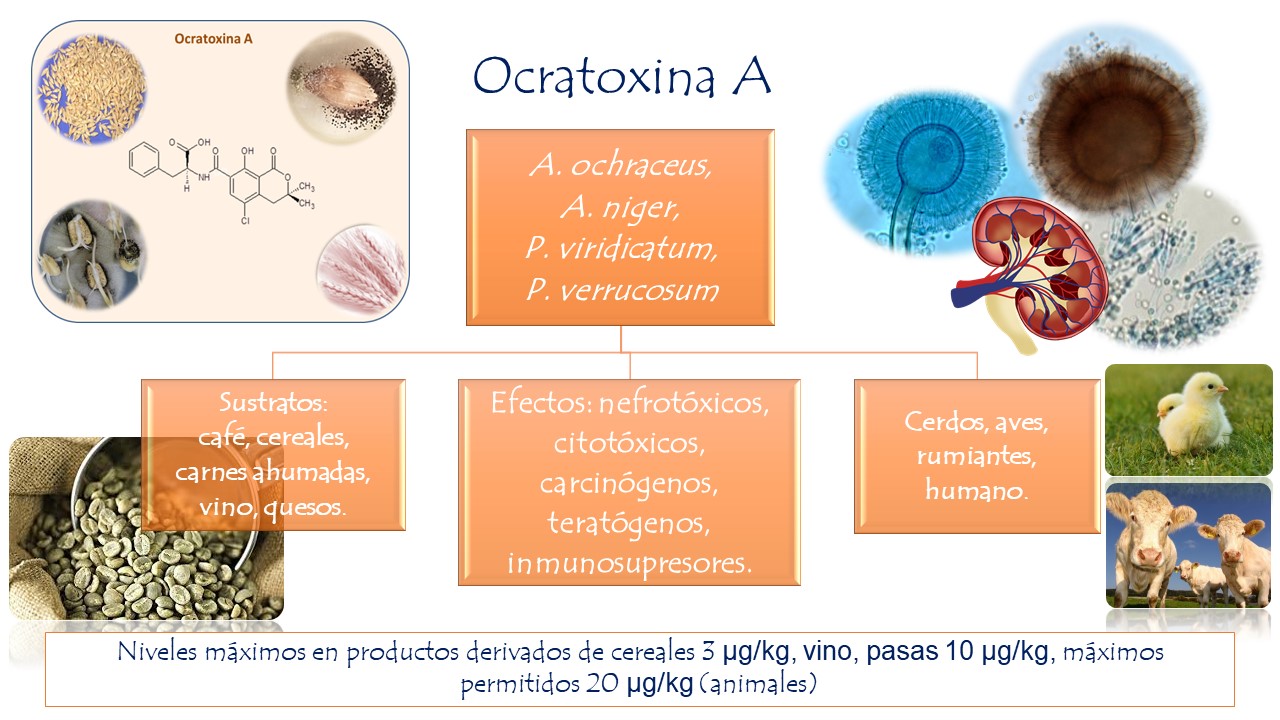
Figura 24. Principales especies de mohos productores de ocratoxina A, sustratos y efectos en el humano y animales.
Patulina
Se ha demostrado que tiene efecto citotóxico afectando el transporte de iones en la membrana celular. Asimismo, presenta un efecto genotóxico por su habilidad de reaccionar con los grupos sulfhidrilos de las proteínas e inhibir las enzimas involucradas en la replicación de material genético. Es producida por Aspergillus clavatus, Aspergillus terreus y algunas especies de Penicillium. Esta micotoxina es posible determinarla en manzanas y jugo de manzana, también en granos, piensos y otros alimentos.
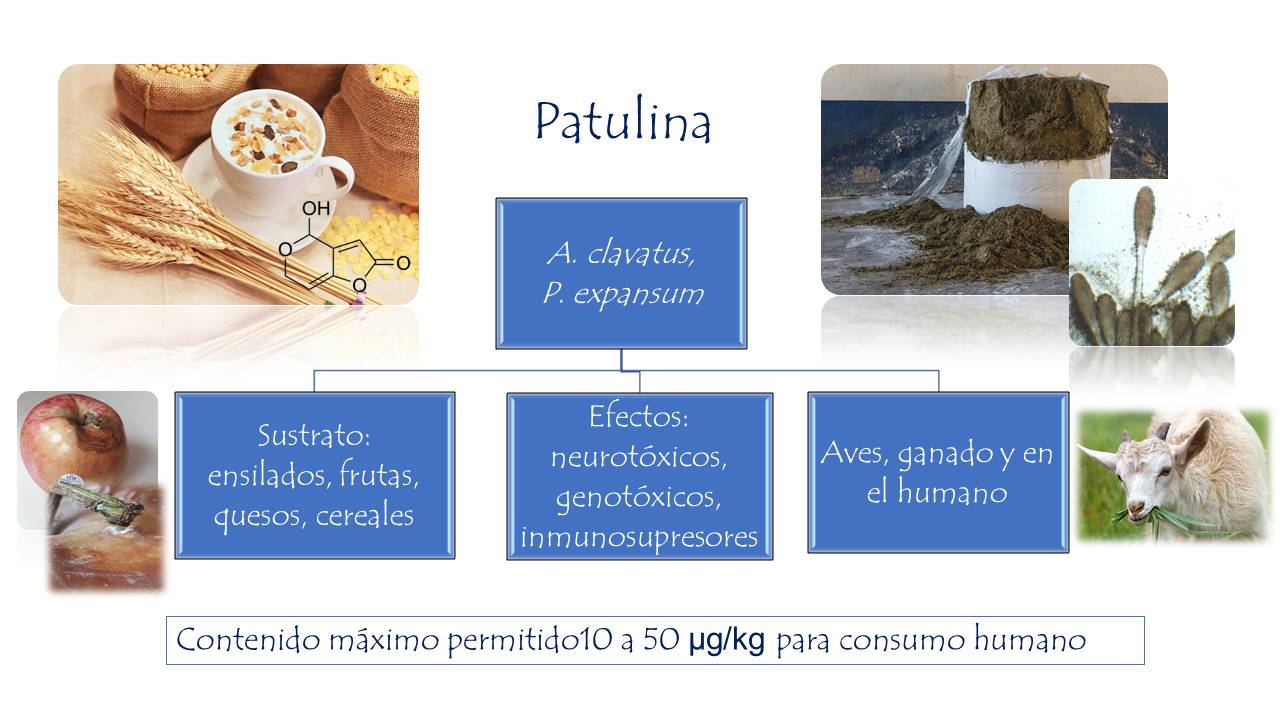
Figura 25. Principales especies de mohos productores de patulina, sustratos y efectos en el humano y animales.