Fucsina ácida
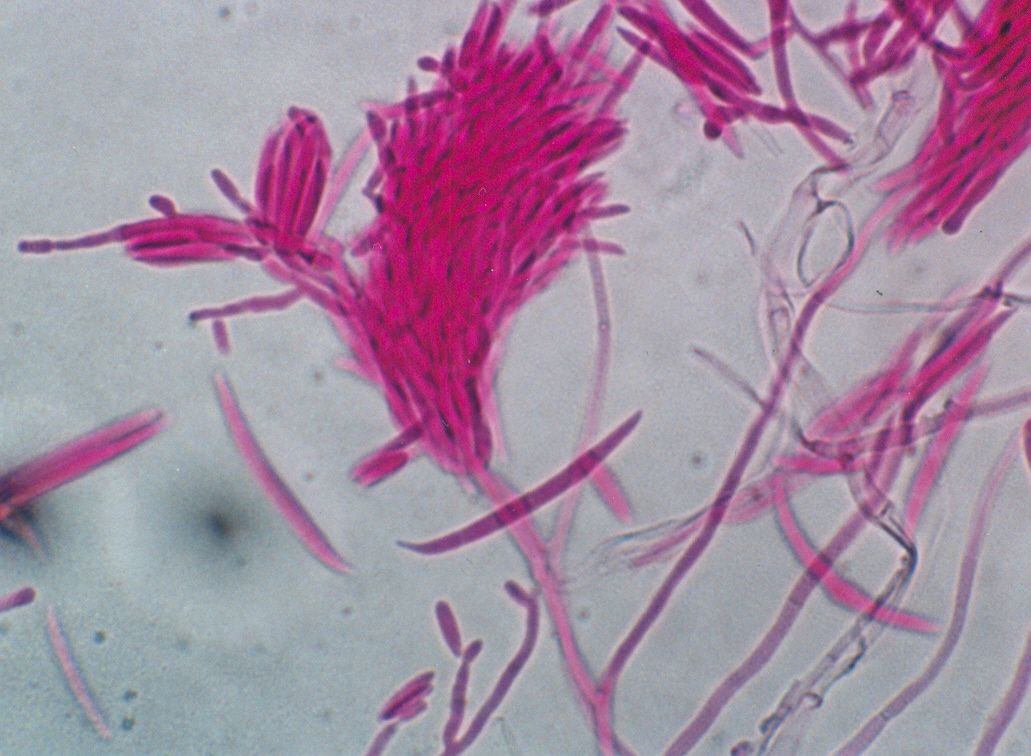
Empleado para la tinción de hongos microscópicos.
Fucsina ácida 1.0 g
Agua destilada 100 ml
Mezclar el colorante con el agua destilada y conservar en un frasco gotero ámbar a temperatura ambiente.
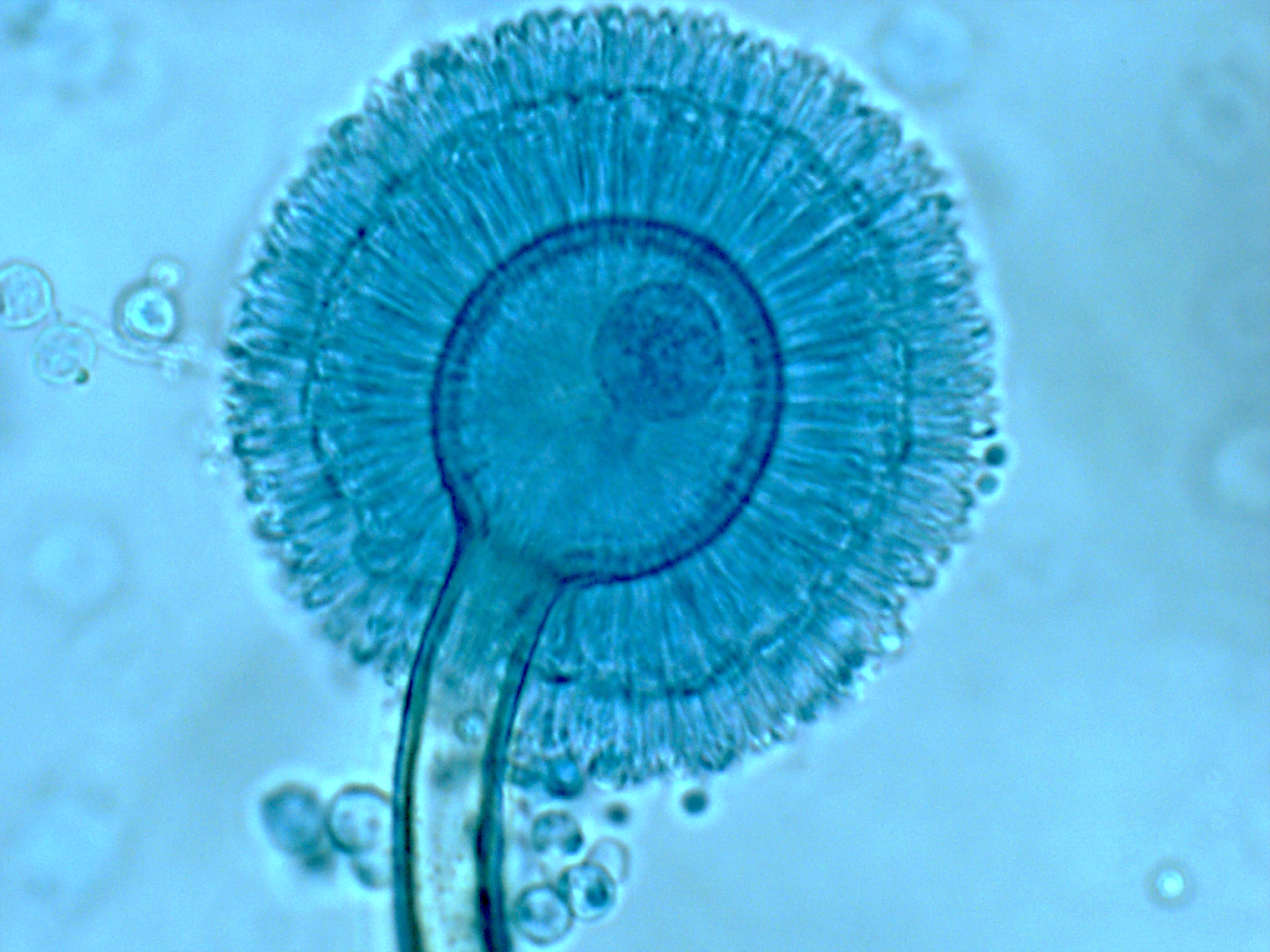
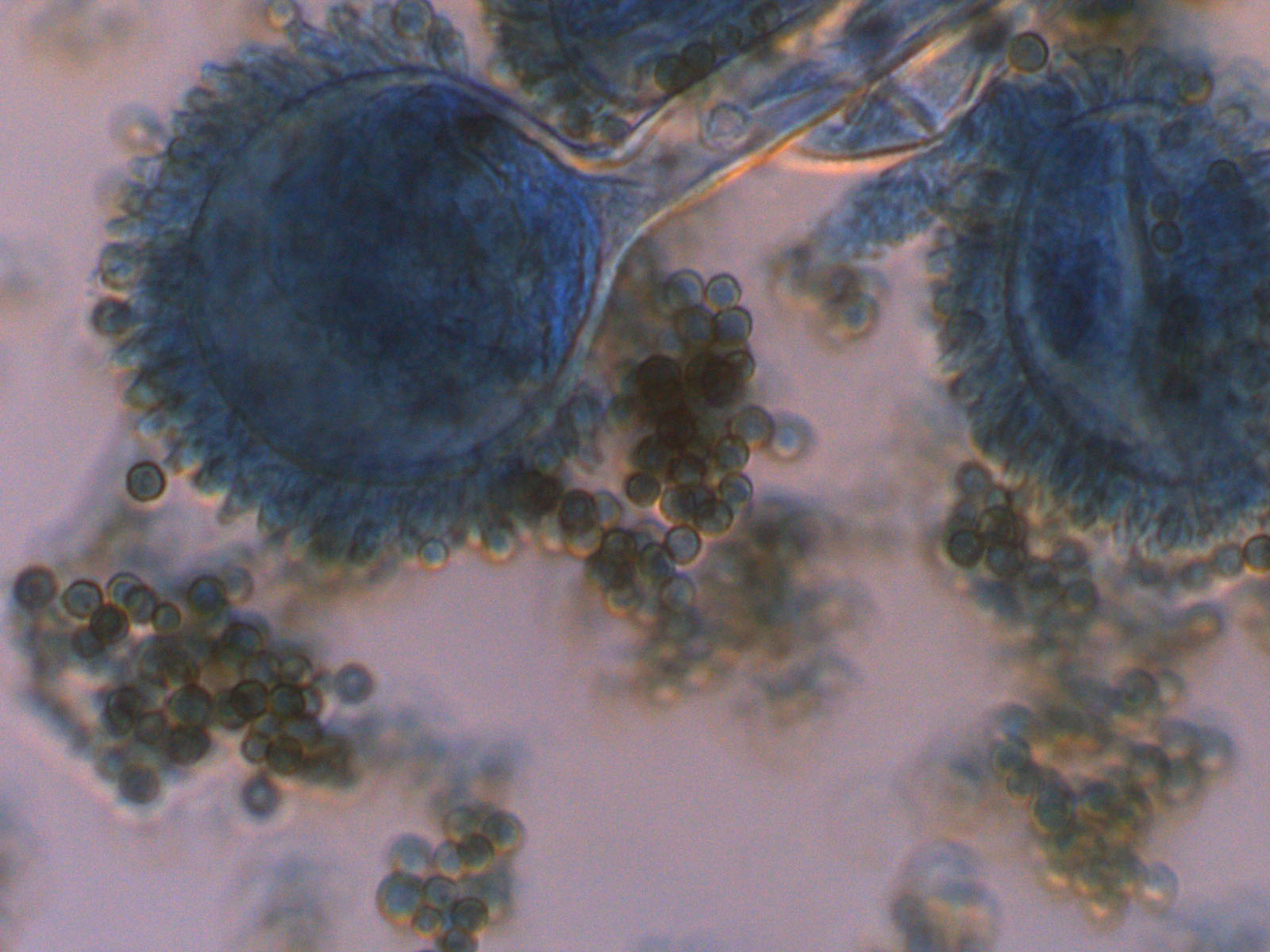
Azul de algodón acidificado.
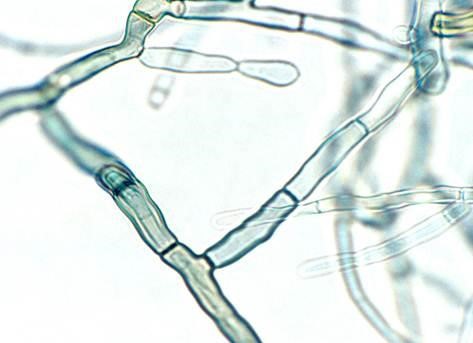
Es un colorante ácido también conocido como azul de anilina, que tiñe el citoplasma y la quitina presente en la pared de las células fúngicas.
Azul de algodón 0.1 g
Agua destilada 100 ml
Ácido láctico (85%) 50 ml
Mezclar vigorosamente el azul de algodón con el agua, adicionar el ácido y mezclar de nuevo, conservar en un frasco gotero ámbar a temperatura ambiente.
Azul de algodón no acidificado
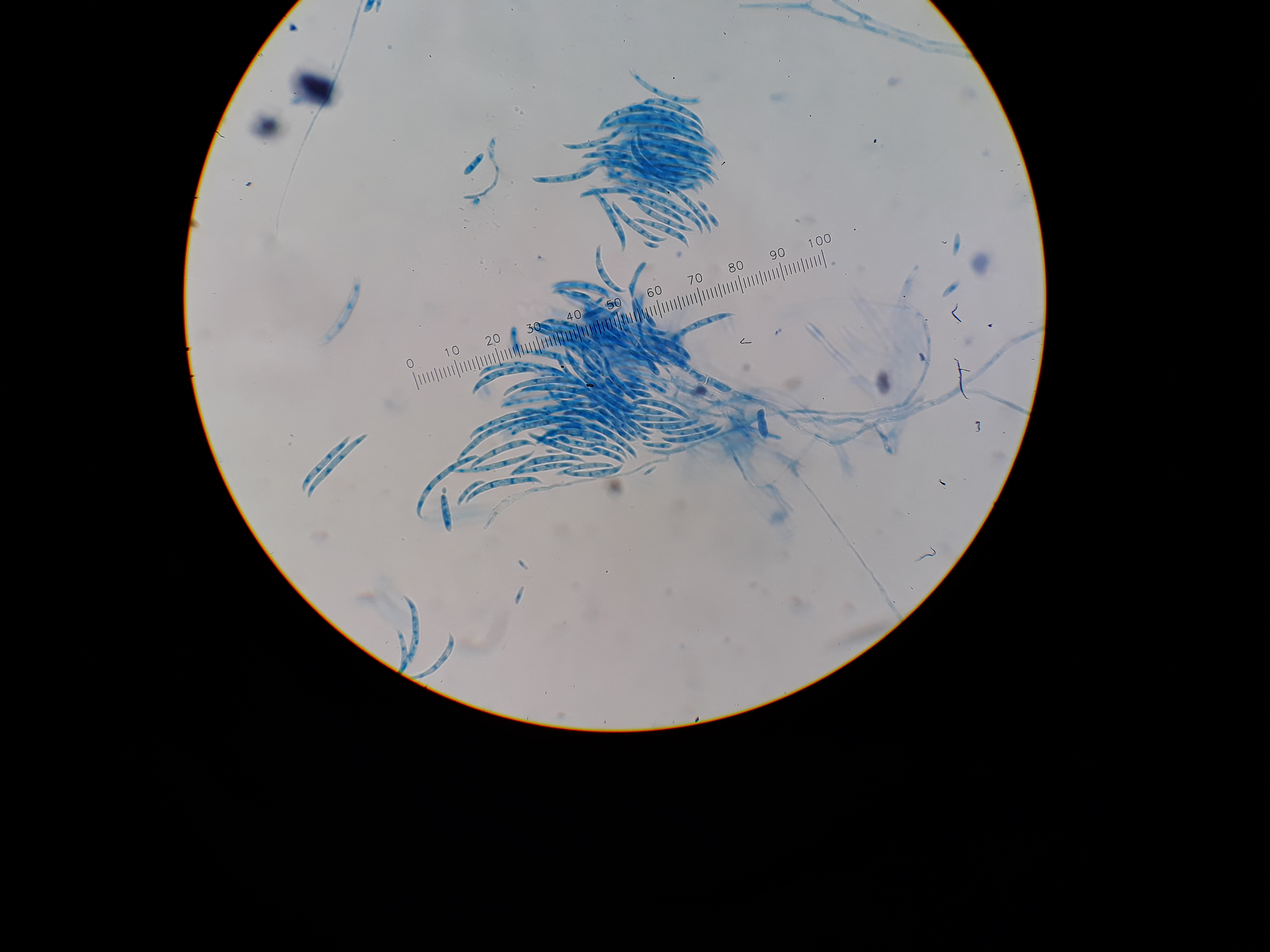
Sirve para teñir la mayoría de las estructuras fúngicas.
Azul de algodón 0.05 g
Agua destilada 100 ml
Mezclar vigorosamente el azul de algodón con el agua destilada, conservar en un frasco gotero ámbar a temperatura ambiente.