Método Múltiple para Zearalenona, Aflatoxinas y Ocratoxinas propuesto por Eppley, 1968
Empaque de la columna de cromatografía
En una columna de vidrio para cromatografía de 22 X 300 mm, colocar una pequeña borla laxa de fibra de vidrio en la base de la columna, agregar 5g de sulfato de sodio anhidro (Na2SO4) grado analítico, para dar una base al gel de sílice, adicionar cloroformo (CHCL3) hasta la mitad de la columna, agregar 10 g de gel de sílice, agitando para dispersar el gel, dejar asentar, drenando algo del CHCL3, pero sin dejar secar el gel, agregar lentamente 15 g de Na2SO4 anhidro y drenar el CHCL3 hasta que sólo cubra la superficie del Na2SO4.
Extracción química
En un matraz Erlenmeyer con tapón de vidrio de 500 ml pesar 50 g de la muestra, agregar 25 ml de agua destilada, 25 g de tierra de diatomeas y 250 ml de cloroformo CHCl3, (grado analítico). Agitar 30 min en agitador de acción de muñeca (Burrel Mod. 75), o tres minutos en licuadora a alta velocidad, emplear licuadora a prueba de explosión (Figuras 1-4).
Figuras 1-4. Empaque de la columna, extracción química y agitación de la muestra.
Filtración
Pasar la muestra a través de papel filtro Whatman Núm.1 plisado o equivalente en un embudo de vidrio de 150 mm de diámetro. Colectar en una probeta de 500 ml, los primeros 50 ml (Figuras 5-7).
Figuras 5-7. Filtración de la muestra.
Purificación
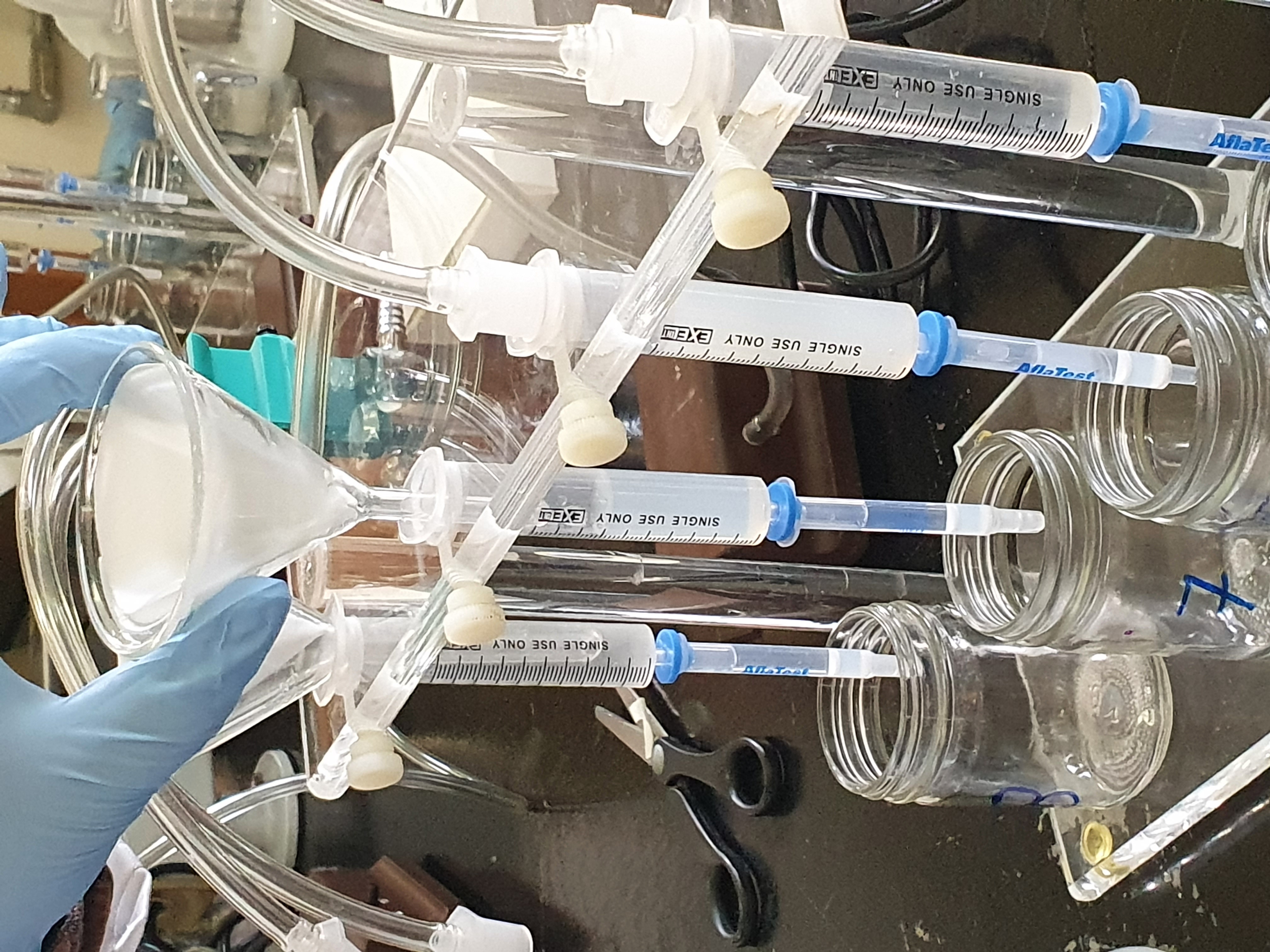
Los primeros 50 ml del filtrado se pasan a través de la columna de cromatografía de gel de sílice.
Eluir con 150 ml de hexano, continuar con 150 ml de benceno (grado analítico) y desechar (flujo máximo, cuidando que no se seque la columna).
Primera fracción
La fracción de zearalenona se eluye, con 250 ml de acetona /benceno 5/95 v/v, en matraces de fondo redondo de 500 ml. Lavar columna con 150 ml de éter etílico y desechar.
Segunda fracción
Eluir las aflatoxinas con 150 ml de metanol / cloroformo 3:97 v/v en matraces de fondo redondo de 250 ml.
Tercera fracción
Eluir las ocratoxinas, con 250 ml de ácido acético glacial/benceno 1/99, v/v en matraces de fondo redondo de 500 ml (Figuras 8-9).
Figuras 8-9. Purificación y elución de zearalenona, aflatoxinas y ocratoxinas.
Evaporación
Evaporar las tres fracciones obtenidas de la columna en rotavapor (Buchi 011 RE111) con baño de vapor (Buchi 461) a 30°C hasta casi sequedad. Colectar las dos fracciones de acetonitrilo (capa inferior) en un matraz de fondo redondo y evaporar hasta sequedad. El residuo de la evaporación de las aflatoxinas y ocratoxinas se transfiere a viales de 20 ml, lavar las paredes del matraz con 10 ml de CHCL3, repartido en tres lavados. El contenido de los viales, se evapora a sequedad en un baño de vapor en atmósfera de nitrógeno y se conservan en congelación hasta el momento de su uso en la cromatografía de capa fina.
Para la fracción de zearalenona se lleva a cabo un paso de partición (26:114) para eliminar los residuos de grasas y pigmentos del extracto (AOAC, 1984). Transferir el residuo de la evaporación a un embudo de separación y lavar 4 veces con 10 ml de benceno y dos veces más con acetonitrilo, primero con 10 y luego con 5 ml. Agitar el embudo de separación y dejar separar las capas. Colectar las dos fracciones de acetonitrilo (capa inferior) en un matraz de fondo redondo y evaporar hasta sequedad. Lavar el matraz con 10 ml de CHCL3 y transferirlo a un vial y evaporarlo a sequedad en baño María y en atmósfera de nitrógeno (Figuras 10-13).
Figuras 10-13. Evaporación de las muestras
Cromatografía en capa fina
Placas preliminares
La cromatografía de capa fina se realiza en placas de vidrio de 20 x 20 cm, precubiertas con gel de sílice con un espesor de 0.25 mm (Merck 5721) o cromatoplacas precubiertas con indicador de fluorescencia (Merck).
Aflatoxinas
Resuspender con 200 µl de benceno / CH3CN 98/2, v/v y agitar durante un minuto en un Vortex.
Hacer las manchas con una microjeringa de 10 µl, colocar dos manchas de 5 µl de la muestra sobre una línea imaginaria a 4 cm del borde inferior de la placa. En esa misma placa colocar manchas de 2, 4 y 8 µl de la solución estándar de aflatoxinas (B1, B2, G1 y G2) y sobre una mancha de 5 µl de la muestra colocar una mancha de 4 µl de la solución estándar como patrón interno.
Las placas se desarrollan en un tanque no equilibrado, ni saturado, con un sistema de solventes acetona / cloroformo, 9 / 1 v/v, durante 40 min a 23-25°C.
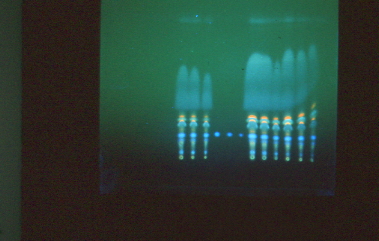
Dejar secar la placa y observar bajo luz ultravioleta de onda larga (360nm).
Las aflatoxinas se observan de color azul (B1 y B2) y verde (G1 y G2), tomando como referencia las manchas de los estándares.
Ocratoxinas
Resuspender con 0.5 ml de ácido acético glacial/ benceno, 1/99 v/v. Agitar durante un minuto en Vortex. Las manchas en la placa se aplican igual que para aflatoxinas.
El estándar es para ocratoxina A y sistema de solventes es ácido acético glacial / benceno, 5/45 v/v. durante 40 min a 23-25°C.
Observar bajo luz ultravioleta de onda larga (360nm).
Identificar las ocratoxinas como manchas verdosas, tomando como referencia las manchas de los estándares.
Zearalenona
Agregar 0.5 ml de benceno, agitar durante un minuto en Vortex.
Colocar dos manchas de 10 µl en la placa. En la misma placa se colocan las manchas del estándar 2, 4 y 8 µl y sobre una de las manchas de 10 µl de la muestra se coloca una mancha de 4 µl del estándar como patrón interno.
El estándar es para zearalenona, las placas se desarrollan en un tanque no equilibrado, ni saturado, con un sistema de solventes de etanol/cloroformo (5/95 v/v) durante 40 min.
Las placas ya secas se observan bajo luz ultravioleta de onda corta (260 nm).
Las manchas positivas se observan con una tonalidad azul, tomando como referencia las manchas de los estándares.
Placas cuantitativas
En estas placas sólo se colocan las muestras positivas detectadas en las placas preliminares, y en las concentraciones estimadas con base en los resultados obtenidos por comparación visual de la placa preliminar para aflatoxinas, ocratoxinas y zearalenona.
Si la placa preliminar sugiere una nueva concentración del extracto de la muestra, evaporar y redisolver en el volumen benceno / CH3CN, 98 / 2, v/v.
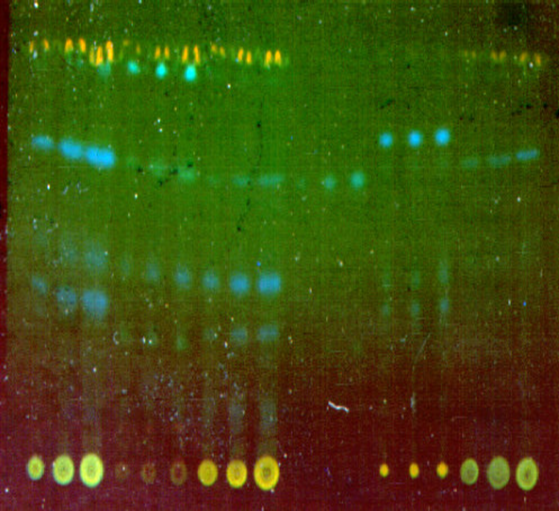
Con una microjeringa de 50 µl se colocan sucesivamente tres manchas de cada muestra (3.5, 5, 6.5 µl), en la misma placa se colocan manchas de 2, 4 y 8 µl de solución estándar, si las manchas de las muestras son muy tenues en la placa preliminar aumentar a (± 10, 20 y 30 µl). Desarrollar igual que en la placa preliminar (Figuras 14-17).
Figuras 14-17. Cromatografía en capa fina
Cálculo de la concentración de aflatoxina B1
La cuantificación se realiza de acuerdo con la siguiente fórmula (26.031) AOAC. (2016).
µg toxina/kg muestra = (SxYxV) / XxW)
En donde:
S= µl estándar aflatoxina B1 igual al problema.
Y= concentración del estándar de aflatoxina B1 µg /ml.
V= µl de la dilución final del extracto de la muestra.
X= µl extracto de la mancha de la muestra con intensidad de fluorescencia igual a S (estándar B1).
W= gramos de muestra aplicados a la columna.
Calcular B2, G1, G2, zearalenona y ocratoxinas igual que para aflatoxina B1.
Pruebas confirmatorias
Para confirmar la identidad de las toxinas detectadas se realizarán las siguientes pruebas.
Aflatoxinas:
Asperjar la placa con una solución de ácido sulfúrico/ agua, 1 /3 v/v. Las manchas de aflatoxinas cambian de tonalidad azul a una amarilla, cuando se observan con luz ultravioleta de onda larga. Si la mancha no presenta este viraje no se trata de aflatoxinas.
Ocratoxinas
Asperjar la placa con una solución alcohólica de bicarbonato de sodio al 1%. Las manchas de ocratoxinas deben virar de tonalidad verdosa a una azul intenso cuando se observan bajo luz ultravioleta de onda larga (360nm).
Zearalenona
Asperjar la placa con una solución de cloruro de aluminio (20 g Cl3Al/ 100 ml OH), la placa se calienta por 5 min 130 °C. Las manchas de zearalenona dejan de ser perceptibles cuando se observan bajo luz ultravioleta de onda corta (260nm), pero reaparecen con una tonalidad azul cuando se observan bajo luz ultravioleta de onda larga (360nm).
Reporte de resultados
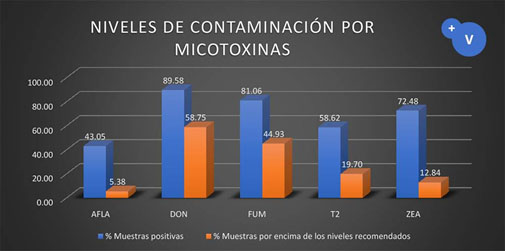
Los resultados se pueden reportar de diversas formas, por ejemplo, elaborando tablas o cuadros y gráficas.
Tabla 1. Niveles de micotoxinas en maíz colectado en el campo en dos municipios del norte de Tamaulipas.
| Municipios |
Núm. parcela |
Zearalenona (µg/kg) |
Aflatoxinas (µg/kg) |
Ocratoxinas (µg/kg) |
| San Fernando |
1 |
trazas |
650 |
nd |
|
2 |
360 |
nd |
nd |
|
3 |
120 |
trazas |
238 |
|
4 |
nd |
10 |
trazas |
| vallahermoso |
1 |
nd |
378 |
56 |
|
2 |
67 |
20 |
nd |
|
3 |
4 |
nd |
115 |
Nd= no detectado; trazas= la intensidad de la mancha es muy débil.
Tabla 2. Niveles de aflatoxinas detectadas en sorgo colectado en el municipio de San Fernando, Tamaulipas, México.
| Municipios |
Núm. parcela |
Aflatoxinas (µg/kg) |
| San Fernando |
1 |
trazas |
|
2 |
4 |
|
3 |
270 |
|
4 |
690 |
|
5 |
nd |
|
6 |
nd |
Nd= no detectado; trazas= intensidad de la mancha es muy débil.
Tabla 3. Concentración de aflatoxinas en muestras de maíz, destinado al consumo humano.
AFLATOXINAS (µg/kg)
| Clave de la muestra |
B1 |
B2 |
G1 |
G2 |
| M-1 |
|
|
|
|
| M-2 |
|
|
|
|
| M-3 |
|
|
|
|
| M-4 |
|
|
|
|
| M-5 |
|
|
|
|
| M-6 |
|
|
|
|
| M-7 |
|
|
|
|
Nd= no detectado; trazas= intensidad de la mancha es muy débil.
Gráfica1. Determinación de diferentes micotoxinas en muestras de maíz.
Bibliografía
Association of Official Analytical Chemists. (2000). Natural Poisons. En Official Methods of Analysis (pp 1184-1213). Arlington: Association of Official Analytical Chemists.
Davis, N. D., Dickens, J. W., Freie, R. L., Hamilton, P. B., Shotwell, O.L. & Wyllie, T.D. (1980). Protocols for surveys, sampling, post collection handling, and analysis of grain sample involved in mycotoxin problems. Journal Association of Official Analytical Chemists, 63, 95-102.
Duracková,Z., Betina, K. & Nemec, P. (1976). Systematic analysis of mycotoxins by thin layer chromatography. Journal Chromatography, 116, 141-154.
Eppley, R.M. (1968). Screening method for zearalenone, aflatoxin, and ochratoxin. Journal of the Association of Official Analytical Chemists, 51, 74-78.
García, G. (1989). Manual de Métodos para el Análisis de Micotoxinas en granos. México, D.F. Programa Universitario de Alimentos.163pp.
Gocan, S. 2002. Stationary phases for Thin- layer chromatography. Journal Chromatographic Science, 40,1-12.
Hagan, N. S. & Tietjen, H. W. (1975). A convenient thin layer chomatographic cleanup procedure for screening several mycotoxins in oils. Journal of the Association of Official Analytical Chemists, 58, 620-621.
Josefson, B. G. C. & Moller, T.E. (1977). Screening method for the rapid detection of aflatoxins, ochratoxin, sterigmatocystin, and zearalenone in cereals. Journal of the Association of Official Analytical Chemists, 60, 1369-1371.
Lade, B., Patil, A., Paikrao, H., Kale, A. & Hire, K. (2014). A Comprehensive Working, Principles and Applications of Thin Layer Chromatography. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 5, 486-503.
Richard, J.L. & Fleetwood, K. (2001). Current Trends in Mycotoxin Analysis. april 16, 2018, de Chemical Compound Sitio web:
Stoloff, L. & Dantzman, J. (1972). Preparation of lot sample of nutmeats for mycotoxin assay. Journal of the Association of Official Analytical Chemists, 49, 264-266.
Stoloff, L., Campbell, D., Beckwith, A. C. Nesheim, S. Winsbush, J. S. & Fordham, O. M. Jr. (1979). Samples preparation for aflatoxin assay: the nature of the problem and approaches to a solution. Journal of the Association of Official Analytical Chemists, 46, 678-684.
Scussel, V. M. 2003.Comparison of methods by TLC and HPTLC for determination of aflatoxin M1 in milkand b1 in eggs. Ciência Tecnologia Alimentos Campinas, 23, 46-52.
Ovorstr, L. J. (1969). A method for the analysis of cereals and groundnuts for three mycotoxins. Analyst, 94, 136-142.
Walking, A. E. (1980). Sampling and preparation of samples of peanut butter for aflatoxin analysis. Journal of the Association of Official Analytical Chemists, 63, 103-106.
Este método no detecta aflatoxinas, lo que detecta son partes de granos/semillas que brillan con una fluorescencia verde amarillo brillante, que generalmente es producida por Aspergillus flavus o A. parasiticus, entre otras, cuando crecen en semillas vivas de maíz, algodón, sorgo, trigo o cebada. Sin embargo, la semilla que muere durante el proceso de secado o por otra razón no produce esta fluorescencia. Esta prueba generalmente está confinada a la parte amilácea de la semilla y a las partes periféricas del embrión, la cual se presenta por una reacción entre el ácido kójico sintetizado por el hongo y una peroxidasa asociada con la semilla viva, observando una fluorescencia verde amarillo brillante. Algunos aislamientos de cepas, además de producir aflatoxinas, también emiten la fluorescencia verde amarillo brillante; sin embargo, se ha encontrado que algunas cepas que producen la fluorescencia sintetizan poca aflatoxina. En semillas muertas se pueden producir aflatoxinas sin que se produzca la fluorescencia típica de la prueba.
Metodología:
El examen de la luz negra debe hacerse en un cuarto oscuro o en una cámara oscura, con luz ultravioleta de longitud de onda de 365 nm.
Una vez obtenida una muestra representativa de un lote.
El grano debe de quebrarse en un molino eléctrico antes de su inspección con la luz negra.
Los granos quebrados se deben observar desde varios ángulos para evitar perder las partículas fluorescentes verde amarillo brillante durante la inspección.

Figura1. Muestras de 5 kg de grano de maíz.

Figura 2. Muestra de maíz quebrado.

Figura 3. Observar la fluorescencia verde amarillo brillante en los granos quebrados bajo luz ultravioleta.
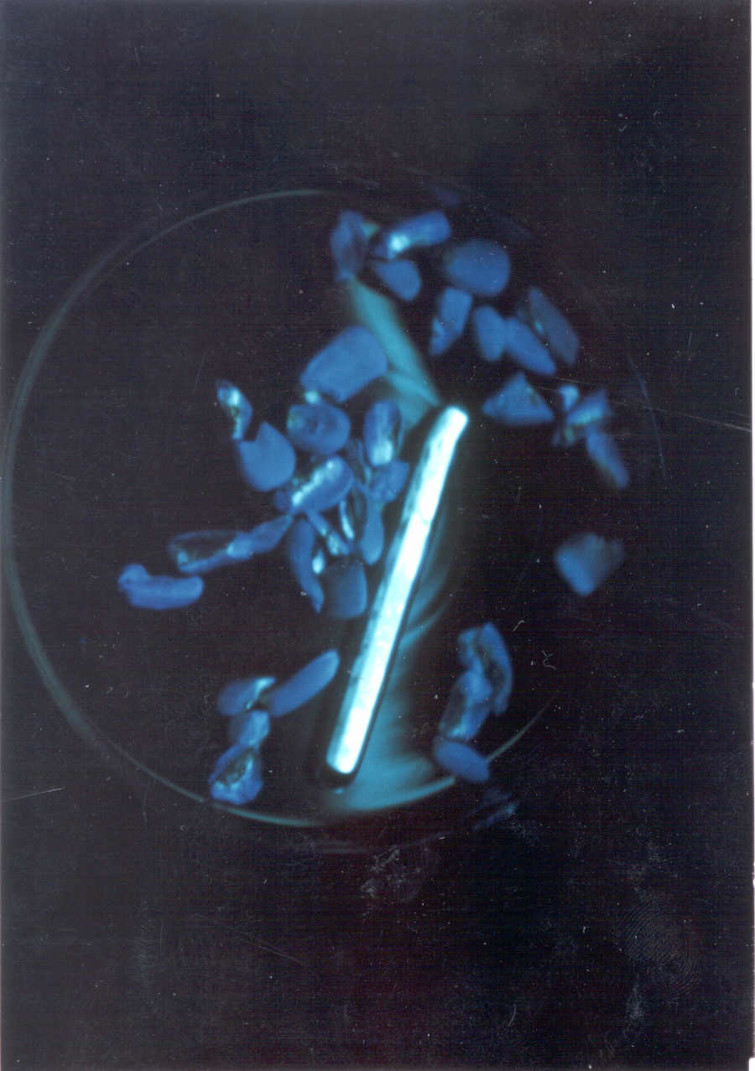
Figura 4. Fluorescencia verde amarillo brillante.
Es muy importante hacer la interpretación correcta de esta prueba para evitar errores en el reporte. Los errores más frecuentes están en la descripción del color y del brillo típico en muestras de semillas, pero principalmente en alimentos. Debido a que algunos materiales extraños y algunas malezas pueden fluorescer del mismo color verde amarillo brillante similares al de la prueba, pero si no se tiene cuidado, se corre el riesgo de reportar muestras falsas positivas. Para reducir estos errores, se pueden usar como patrones de referencia partículas de semillas positivas que no hayan sido muy expuestas a la luz UV, un patrón de color, confirmar la solubilidad del material fluorescente y comprobar que la partícula fluorescente proviene del endospermo amiláceo o de fragmentos del embrión de la semilla.
Se recomienda usar una lámpara de alta intensidad y lentes de seguridad (goggles) protectores para luz ultravioleta, que además de incrementar el contraste, previenen el posible daño en los ojos debido a la exposición continua a este tipo de luz. La prueba de la luz negra no determina aflatoxinas, es una prueba estrictamente presuntiva, pero cuando se presentan una o más partículas por kilogramo, la muestra debe ser considerada positiva y cuantificarse por métodos analíticos para aflatoxinas.
Bibliografía
García, G. (1989). Manual de Métodos para el Análisis de Micotoxinas en granos. México, D.F. Programa Universitario de Alimentos.163pp.
Shotwell, O. L. y C. W, Hesseltine.1981. Use of bright greenish yellow fluorescence as a presumptive test for aflatoxin in 1978 corn. Cereal Chem. 58: 124: 387.